
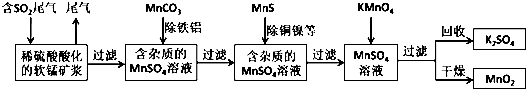
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)脱硫能减少酸雨;
(2)MnCO3消耗溶液中的酸,促进Al3+和Fe3+水解;
(3)根据盖斯定律解题,Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将③-②-①可得;
(4)锰离子在阳极失电子生成二氧化锰;
(5)二氧化锰得电子碱溶液中生成MnO(OH);
(6)SO2+MnO2=MnSO4,根据方程式结合元素守恒解题,反应的二氧化硫的物质的量为 $\frac{a×1000}{22.4}$×b%×89.6%=0.4abmol,根据SO2+MnO2=MnSO4可知生成硫酸锰的物质的量为0.4abmol,最终生成的二氧化锰为c kg.
解答 解:(1)脱硫能减少酸雨和废物在利用,白色污染的减少是塑料的减少和流程无关,
故答案为:AC;
(2)MnCO3消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将③-②-①可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol,
故答案为:MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
(4)锰离子在阳极失电子:Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(5)二氧化锰得电子生成MnO(OH),MnO2+H2O+e-=MnO(OH)+OH-,
故答案为:MnO2+H2O+e-=MnO(OH)+OH-;
(6)反应的二氧化硫的物质的量为 $\frac{a×1000}{22.4}$×b%×89.6%=0.4abmol,根据SO2+MnO2=MnSO4可知生成硫酸锰的物质的量为0.4abmol,最终生成的二氧化锰为c kg,设消耗硫酸锰的物质的量为x,
2KMnO4+3MnSO4+2H2O═5MnO2+2H2SO4+K2SO4
3 87×5
x 1000c
x=$\frac{3000c}{435}$
除去铁、铝、铜、镍等杂质时,所引入的锰元素($\frac{3000c}{435}$-0.4ab)mol,
相当于MnO2的质量($\frac{3000c}{435}$-0.4ab)mol×87g/mol=(600c-0.4ab×87)g=$\frac{1500c-87ab}{2500}$kg,
故答案为:$\frac{1500c-87ab}{2500}$.
点评 本题考查热化学方程式、原电池、电解池和化学计算等,侧重于学生的分析能力和实验能力的考查,难度中等.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
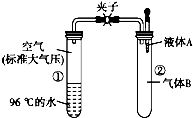 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2晶体中含有的阴离子数目为2NA | |
| B. | 1 mol Na2O2与足量CO2反应时,转移2NA个电子 | |
| C. | 1 mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1 mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.| 操作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com