
| A. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| B. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂 |
分析 A.水晶主要成分是二氧化硅;
B.二氧化硫具有还原性,能够还原溴水使其褪色;
C.氢氧化钠溶于水放出大量的热量,而氨气易挥发,则浓氨水滴入氢氧化钠固体里可制得氨气;
D.碳酸氢钠不稳定受热易分解.
解答 解:A.水晶主要成分是二氧化硅,是氧化物,不是硅酸盐,故A错误;
B.SO2可以使溴水褪色,体现二氧化硫的还原性,故B错误;
C.氢氧化钠固体具有吸水性,溶于水放出大量的热量,而氨气易挥发,则浓氨水滴入氢氧化钠固体里可制得氨气,并且能够节约氨水的用量,可以制取氨气,故C正确;
D.碳酸氢钠不稳定受热易分解,生成二氧化碳,因此食品工业上用作焙制糕点的膨松剂,故D错误;
故选:C.
点评 本题考查元素化合物知识,熟悉硅酸盐概念、二氧化硫、氨水、碳酸氢钠的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
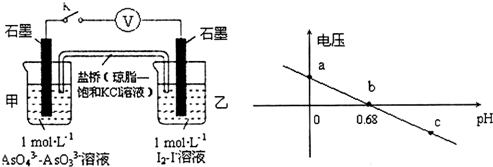
| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
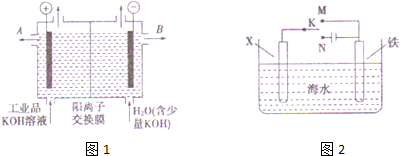
 氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:
氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com