
|
制取水煤气的反应为C(s)+H2O(g)
| |
| [ ] | |
A. |
加压 |
B. |
升温 |
C. |
增大水蒸气浓度 |
D. |
增大碳的物质的量 |
 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:选择题
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
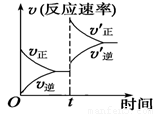
A.加压 B.升温
C.增大水蒸气浓度 D.增大碳的物质的量
查看答案和解析>>
科目:高中化学 来源:2015届海南三亚一中高二上学期期中考试理科化学试卷(B)(解析版) 题型:选择题
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
A.加压 B.升温 C.增大水蒸气浓度 D.增大碳的物质的量
查看答案和解析>>
科目:高中化学 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:填空题
(共10分)
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。

①图中所示反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”、“不需要”或“不一定”)加热,该反应的△H = (用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是____________________________________。
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ ①C(s)+O2(g) === CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:②C(s)+H2O(g) === CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
③2CO(g)+O2(g) === 2CO2(g) ΔH3<0 ④2H2(g)+O2(g) === 2H2O(g) ΔH4<0
请回答下列问题:
①判断两种途径放热:途径Ⅰ放出的热量________途径Ⅱ放出的热量(填“大于”、“等于”或“小于”)。
②ΔH1、ΔH2、ΔH3、ΔH4的数学关系是_________________________________。
③由于制取水煤气的反应里,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________能量才能转化为生成物,因此其反应条件为________。
(3)已知:Fe2O3(s)+3CO(g) === 2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g) === 2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g) === 3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
请写出CO还原FeO的热化学方程式:______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com