
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 离子半径:Cl->S2->K+ |
分析 A.非金属性越强,氢化物越稳定;
B.同周期原子序数大的原子半径小;电子层越多,原子半径越大;
C.非金属性越强,对应最高价氧化物的水化物酸性越强;
D.具有相同电子排布的离子,原子序数大的离子半径小.
解答 解:A.非金属性越强,氢化物越稳定,则热稳定性:HF>H2O>H2S,故A错误;
B.同周期原子序数大的原子半径小;电子层越多,原子半径越大,则原子半径为Na>Mg>O,故B正确;
C.非金属性越强,对应最高价氧化物的水化物酸性越强,则酸性为H3PO4<H2SO4<HClO4,故C错误;
D.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为S2->Cl->K+,故D错误;
故选B.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
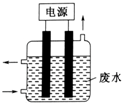
| A. | 该电解装置电极材料均为铁 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 该装置排放出的气体主要为N2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO任意排放会造成大气污染 | |
| B. | 汽车尾气、制硝酸工厂的废气均含NO | |
| C. | NO是造成光化学烟雾的唯一直接原因 | |
| D. | NO分子所含电子总数为奇数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
 .
. ,合成路线流程图为:
,合成路线流程图为: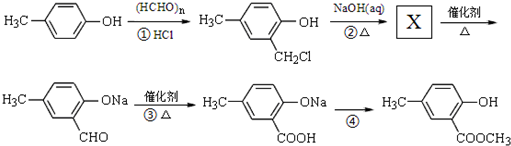
 ;
; 任意一种.
任意一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com