
下列常见金属的冶炼原理中不合理的是
| 金属 | 冶炼原理 |
A | Fe |
|
B | Hg |
|
C | Al |
|
D | Mg |
|
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:填空题
(7分)请根据所学化学知识回答下列问题:
(1)在浓度均为0.1 mol/L ①CH3COONH4、②NH4HSO4、③NH3·H2O、④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)。
(2)氯化铝溶液蒸干,灼烧得到的固体物质是_________,用化学方程式说明其原因:
(3)某温度时蒸馏水的pH=6。将2.3 g金属钠放入该蒸馏水中,充分反应后再加该蒸馏水稀释到1 L,恢复到原温度时所得溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省眉山市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.25℃时,pH=7的CH3COOH与CH3COONa的混合液中离子浓度的大小顺序为:
c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
B.25℃时,0.1mol/L NaHA溶液pH=3,该溶液中某些微粒的浓度大小顺序为:
c(HA-)>c(H+)>c(H2A)>c(A2-)
C.25℃时,若10mL pH=a的盐酸与100mL pH=b 的Ba(OH)2溶液混合后恰好中和,则a+b=13
D.25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L 的NaF溶液与0.1mol/L 的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
下列基态原子或离子核外未成对电子数目为5的是
A.Fe3+ B.P C.Cr D.Cu
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
下面有关晶体的叙述中,不正确的是
A.氯化钠晶体中,每个Na+周围紧邻6个Cl-
B.氯化铯晶体中,每个CS+周围紧邻8个Cl-
C.氟化钙晶胞中,每个F-周围紧邻8个Ca2+、每个Ca2+周围紧邻8个F-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市高三第三次诊断性考试理综化学试卷(解析版) 题型:实验题
(14分)水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:
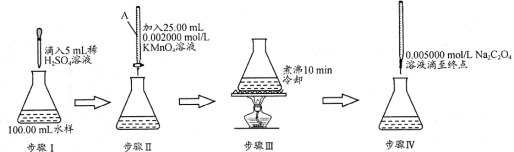
(1)仪器A为 (填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为 。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+ MnO4—+ = Mn2++ CO2↑+
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是 。
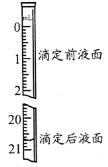
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请在图中标出滴定前的液面。
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时 。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) 。
资料卡片:
1、有机质可HNO3被氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数,下列说法一定正确的是
A、4g D2和足量O2反应可生成D2O 2NA个
B、1molNa完全燃烧可转移电子NA个
C、6.02×1023个葡萄糖分子约含羟基6NA个
D、98g H3PO4和H2SO4的混合物中含氢原子2.5NA个
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:选择题
下列结论正确的是 ( )
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
A.①④⑤ B.③⑥ C.②④⑤⑥ D.①③④
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl。以下对铊的单质及其化合物的性质推断中,不正确的是( )
A、铊是易导电的银白色金属 B、铊能生成+3价的离子
C、Tl3+的氧化能力比Al3+强 D、氢氧化铊的碱性比氢氧化铝强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com