
| A. | 热稳定性:HCl>H2Se>HBr | B. | 还原性:Se2->S2->Cl- | ||
| C. | 原子半径:Se>Cl>P | D. | 酸性:H2SeO4>H2SO4>H3PO4 |
分析 元素周期表中,同一周期元素从左到右,原子半径逐渐减小,非金属性逐渐增强,金属性逐渐减弱,元素的非金属性越强,对应的氢化物越稳定,最高价氧化物对应的水化物的酸性越强,阴离子的还原性越弱,以此解答.
解答 解:A.非金属性:Cl>Br>Se,元素的非金属性越强,对应的氢化物越稳定,HCl>HBr>H2Se,故A错误;
B.非金属性Cl>S>Se,元素的非金属性越强,对应的阴离子的还原性越弱,则还原性Se2->S2->Cl-,故B正确;
C.同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,则应有Se>P>Cl,故C错误;
D.非金属性S>P>Se,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性H2SO4>H3PO4>H2SeO4,故D错误;
故选B.
点评 本题考查元素周期律知识,侧重于学生的分析能力的考查,为高考常见题型,注意把握元素的性质与对应单质、化合物的关系,难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3→CO2 | B. | HClO→O2 | C. | HCl(浓)→MnCl2 | D. | NaBr→NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂可加快SO2转化为SO3的速率 | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 装有NO2、N2O4平衡混合气的玻璃球在冷水中气体颜色变浅 | |
| D. | SO2通入氯水,氯水的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应可能是吸热反应也可能是放热反应 | |
| B. | 1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 催化剂表面做成蜂窝状更有利于提高催化效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
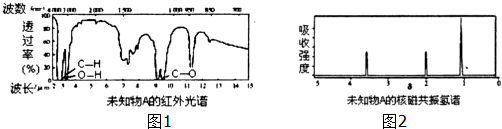
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中的各个主族都有非金属元素 | |
| B. | 周期表中的各个主族都有金属元素 | |
| C. | 周期表中的非金属元素都位于主族(除稀有气体) | |
| D. | 周期表中的非金属元素都位于短周期内 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
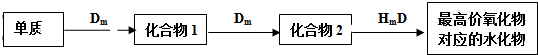
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.
今有碱金属的两种碳酸盐和碱土金属(第二主族)的一种不溶性碳酸盐组成的混合物,取其7.560g与过量盐酸完全反应,放出CO2体积为1.344L(标况下)另取等质量的原混合物,加水搅拌,可滤出不溶性盐1.420g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com