
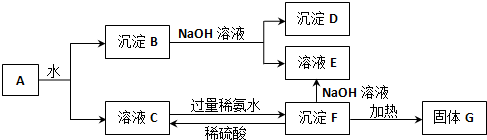
分析 某混合物A含有Al2(SO4)3、Al2O3和Fe2O3,将A溶于水,Al2(SO4)3溶于水,Al2O3和Fe2O3不溶于水,分离难溶性固体和溶液采用过滤方法,得到的滤液C中含有Al2(SO4)3,滤渣B为Al2O3和Fe2O3,向B中加入NaOH溶液,发生反应Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3和NaOH不反应,过滤得到滤渣D为Fe2O3,滤液E中含有NaAlO2,向硫酸铝溶液中加入过量氨水得到沉淀F为Al(OH)3,加热分解得到的G为Al2O3,结合对应物质的性质以及题目要求解答该题.
解答 解:某混合物A含有Al2(SO4)3、Al2O3和Fe2O3,将A溶于水,Al2(SO4)3溶于水,Al2O3和Fe2O3不溶于水,分离难溶性固体和溶液采用过滤方法,得到的滤液C中含有Al2(SO4)3,滤渣B为Al2O3和Fe2O3,向B中加入NaOH溶液,发生反应Al2O3+2NaOH=2NaAlO2+H2O,Fe2O3和NaOH不反应,过滤得到滤渣D为Fe2O3,滤液E中含有NaAlO2,向硫酸铝溶液中加入过量氨水得到沉淀F为Al(OH)3,加热分解得到的G为Al2O3,
(1)可通过过滤的方法分离沉淀B与溶液C,故答案为:过滤;
(2)由以上分析可知,D为Fe2O3,E为NaAlO2,F为Al(OH)3,G为Al2O3,故答案为:Fe2O3;NaAlO2;Al(OH)3;Al2O3;
(3)滤渣B为Al2O3和Fe2O3,向B中加入NaOH溶液,发生反应Al2O3+2NaOH=2NaAlO2+H2O,离子方程式为Al2O3 +2OH-=2AlO2-+H2O,
F为Al(OH)3,与稀硫酸反应生成硫酸铝,反应的离子方程式为Al(OH)3 +3H+=Al3++3H2O,
滤液C中含有Al2(SO4)3,加入氨水生成氢氧化铝,反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al2O3 +2OH-=2AlO2-+H2O;Al(OH)3 +3H+=Al3++3H2O;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)检验溶液中是否含有Fe3+,需用的试剂是KSCN,发生络合反应,溶液变为血红色,故答案为:KSCN溶液;溶液变为血红色.
点评 本题考查混合物的分离和提纯,为高频考点,明确物质的性质是解本题关键,知道每个过程发生的反应及溶液中的溶质、沉淀成分,知道常见物质分离提纯方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 100mL 0.5mol•L-1 HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件组合是①②④.(填相应的数字序号)
(1)某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需的最少条件组合是①②④.(填相应的数字序号)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 二氧化硫能使浸过酸性高锰酸钾溶液的滤纸褪色说明二氧化硫具有漂白性 | |
| B. | 将收集满二氧化氮气体的试管倒立在水中,水会充满试管 | |
| C. | 氨气可以做喷泉实验,这是利用氨气极易溶于水的性质 | |
| D. | 在实验室中,不能利用稀硝酸与锌粒反应制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 胃酸过多的病人,可以服用氢氧化钠来中和胃酸 | |
| B. | 晶体硅是在通信工程中制作光导纤维的主要原料 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存 | |
| D. | 二氧化硅与氢氟酸的反应原理可用来雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度C(甲)=C(乙) | |
| B. | 甲中由水电离产生的H+的物质的量浓度是乙的0.1倍 | |
| C. | 中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)=10V(甲) | |
| D. | 甲中的C(OH-)为乙中C(OH-)的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>③>② | B. | ②>③>① | C. | ③>②>① | D. | ①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
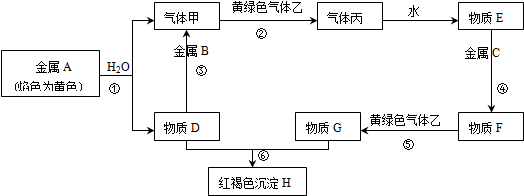
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com