
【题目】将ag铁和氧化铁的混合物加入800mL0.1mol/L 的盐酸中充分反应后,盐酸全部消耗,放出标准状兄下气体0.224L。则下列判断中正确的是 ( )
A. 原混合物中n (Fe) :n (Fe2O3) =2: 1 B. 向溶液中滴入KSCN 溶液,显血红色
C. 无法计算出原混合物的质量 D. 此混合物中铁元素的质量分数为68.6%
【答案】A
【解析】因该混合物中只有铁和盐酸反应放出气体,则该气体一定是氢气。由于氧化性Fe3+>H+,所以当产生氢气时,Fe3+已经全部被还原为Fe2+,生成氢气的物质的量为:0.224L÷22.4L/mol=0.01mol,HCl物质的量为0.8L×0.1mol/L=0.08mol,发生反应:Fe+2HCl=FeCl2+H2↑,消耗Fe为0.01mol,消耗HCl为0.01mol×2=0.02mol,故反应Fe+Fe2O3+6HCl=3FeCl2+3H2O,消耗HCl的物质的量为:0.08mol0.02mol=0.06mol,由方程式可知该反应中消耗Fe为0.06mol×![]() =0.01mol,Fe2O3的物质的量=0.06mol×
=0.01mol,Fe2O3的物质的量=0.06mol×![]() =0.01mol。由以上分析可知,A. 原混合物中n(Fe):n(Fe2O3)=(0.01mol+0.01mol):0.01mol=2:1,故A正确;B. 反应后得到的是FeCl2溶液,向溶液中滴入无色的KSCN溶液,不显血红色,故B错误;C. Fe、氧化铁的物质的量已经计算出,根据m=n×M可以计算混合物的质量,故C错误;D. 根据上述分析可知,原混合物中铁的物质的量是0.02mol,Fe2O3的物质的量是0.01mol,则此混合物中铁元素的质量分数为:
=0.01mol。由以上分析可知,A. 原混合物中n(Fe):n(Fe2O3)=(0.01mol+0.01mol):0.01mol=2:1,故A正确;B. 反应后得到的是FeCl2溶液,向溶液中滴入无色的KSCN溶液,不显血红色,故B错误;C. Fe、氧化铁的物质的量已经计算出,根据m=n×M可以计算混合物的质量,故C错误;D. 根据上述分析可知,原混合物中铁的物质的量是0.02mol,Fe2O3的物质的量是0.01mol,则此混合物中铁元素的质量分数为:![]() ×100%=82.4%,故D错误;答案选A。
×100%=82.4%,故D错误;答案选A。


科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:
(1)同物质的量的A、B、C、D燃烧,耗氧量最大的是(填对应字母); 同质量的A、B、C、D燃烧,耗氧量最大的是(填对应字母);
(2)所有原子都在同一平面上的是(填对应字母);
(3)能使酸性高锰酸钾褪色的是(填对应字母);
(4)写出C发生聚合反应的化学方程式;
(5)写出实验室制取D的化学方程式;
(6)写出G和硝酸反应的化学方程式 . 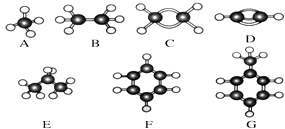
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:
按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/gcm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是(填入正确选项前的字母);
A.重结晶
B.过滤
C.蒸馏
D.萃取
(4)在该实验中,a的容积最适合的是(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)写出a中反应的主要有机化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳的氧化物直接合成乙醇燃料已进入大规模生产.
(1)如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H;若密闭容器中充有10molCO与20molH2 , 在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如图1所示. 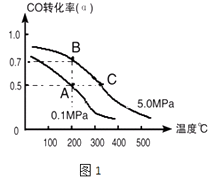
已知:2CO(g)+O2(g)═2CO2(g)△H1=﹣566kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H2=﹣572kJmol﹣1
CH3CH2OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=﹣1366kJmol﹣1
H2O(g)═H2O(l)△H4=﹣44kJmol﹣1
①△H=kJmol﹣1
②若A、C两点都表示达到的平衡状态,则从反应开始到达平衡状态所需的时间tAtC(填“>”、“<”或“﹦”).
③若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=;
④熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)格负极燃气,空气与CO2的混合气为正极助燃气,用一定比例Li2CO3和Na2CO3低熔混合物为电解质,以金属镍(燃料极)为催化剂制成的.负极上CO反应的电极反应式为 .
(2)工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数.请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: .
(3)目前工业上也可以用CO2来生产甲醇.一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g).若将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线). 
①请在图中绘出甲醇的物质的量随时间变化曲线.
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 , 曲线Ⅱ对应的实验条件改变是 .
(4)将标准状况下4.48L CO2通入1L 0.3molL﹣1NaOH溶液中完全反应,所得溶液中微粒浓度关系正确的是 A.c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)
B.c(OH﹣)+c(CO32﹣)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣)
D.2c(Na+)=3c(HCO3﹣)+3c(CO32﹣)+3c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下: 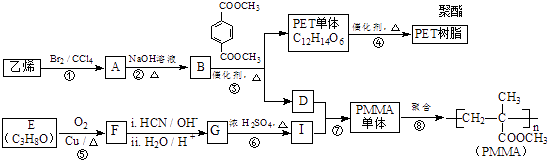
已知:
Ⅰ.RCOOR′+R″18OH ![]() RCO18OR”+R′OH(R、R′、R″代表烃基)
RCO18OR”+R′OH(R、R′、R″代表烃基)
Ⅱ. 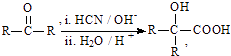 (R、R′代表烃基)
(R、R′代表烃基)
(1)①的反应类型是 .
(2)②的化学方程式为 .
(3)PMMA单体的官能团名称是、 .
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为 .
(5)G的结构简式为 .
(6)下列说法正确的是(填字母序号). a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1mol 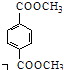 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH
(7)写出由PET单体制备PET聚酯并生成B的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 过滤可以除掉粗盐中可溶于水的杂质
C. 碘易溶于有机溶剂,可用CCl4萃取碘水中的碘
D. 用托盘天平称量固体药品时,砝码放在右盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应而使溴水褪色,又能使高锰酸钾酸性溶液褪色的是( )
①CH3CH2CH2CH3 ②CH3CH2CH===CH2

A.①②③④ B.②③④
C.②④ D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
A.在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为 ![]() NA
NA
B.1mol碳正离子CH5+所含的电子数为10NA
C.标准状况下,16g甲烷完全燃烧所消耗的氧气的分子数的3NA
D.0.5molC3H8分子中含C﹣H共价键2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com