
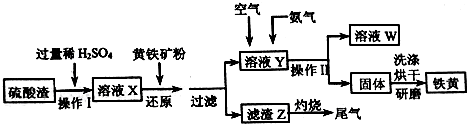
分析 硫酸渣中含Fe2O3、CaO、MgO等,用稀硫酸溶解,过滤除去不溶物,再加FeS2发生反应FeS2+H2SO4(稀)═FeSO4+H2S↑+S↓,H2S可以将Fe3+还原为Fe2+,过滤分离,滤渣含有S、FeS2等,滤液中含有Fe2+,通入空气氧化将将Fe2+氧化成Fe3+,氨气反应得到Fe(OH)3,过滤分离,烘干得到铁黄,液E中含有硫酸铵等.
(1)增大接触面积,升高温度等都可提高硫酸渣的溶解速度;
(2)H2S可以将Fe3+还原为Fe2+,同时生成S;
(3)操作Ⅱ是过滤,用到的玻璃仪器有:烧杯、漏斗、玻璃棒;
(4)在溶液Y中通入空气将亚铁离子氧化为铁离子,通入NH3后,铁离子与氨水反应生成氢氧化铁沉淀;
(5)利用品红溶液检验尾气中含有SO2;
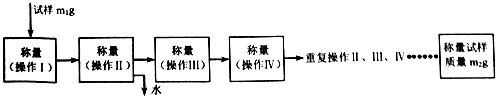
(6)质量减轻为结晶水的质量,结合化学式Fe2O3•xH2O计算铁黄中结晶水数目;
(7)Fe2+离子被氧化为Fe3+,高锰酸根被还原为Mn2+,当滴入最后一滴高锰酸钾溶液时,溶液变成浅紫色,且半分钟不恢复原色.
解答 解:硫酸渣中含Fe2O3、CaO、MgO等,用稀硫酸溶解,过滤除去不溶物,再加FeS2发生反应FeS2+H2SO4(稀)═FeSO4+H2S↑+S↓,H2S可以将Fe3+还原为Fe2+,过滤分离,滤渣含有S、FeS2等,滤液中含有Fe2+,通入空气氧化将将Fe2+氧化成Fe3+,氨气反应得到Fe(OH)3,过滤分离,烘干得到铁黄,液E中含有硫酸铵等.
(1)适当增加稀硫酸浓度、提高反应温度、粉碎硫酸渣增大接触面积等,都可提高硫酸渣的溶解速度;
故答案为:提高反应温度、粉碎硫酸渣增大接触面积;
(2)H2S可以将Fe3+还原为Fe2+,同时生成S,反应离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
(3)操作Ⅱ是过滤,除用到玻璃棒外,还需要的玻璃仪器是:烧杯、普通漏斗,
故答案为:烧杯、普通漏斗;
(4)在溶液Y中通入空气的目的是:做氧化剂,将Fe2+氧化成Fe3+,通入NH3发生的离子反应为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:做氧化剂,将Fe2+氧化成Fe3+;Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(5)验证滤渣Z灼烧的尾气中含有SO2的方法:将气体通入品红溶液,溶液褪色,加热恢复原来的颜色,
故答案为:将气体通入品红溶液,溶液褪色,加热恢复原来的颜色;
(6)结晶水的质量为(m1-m2)g,则$\frac{{m}_{1}-{m}_{2}}{{m}_{2}}$=$\frac{160}{18x}$,解得x=$\frac{80{m}_{2}}{9({m}_{1}{-m}_{2})}$,
故答案为:$\frac{80{m}_{2}}{9({m}_{1}{-m}_{2})}$;
(7)用酸性高锰酸钾标准溶液滴定某亚铁盐溶液中Fe2+离子的浓度,该反应的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定终点的判断方法为:当滴入最后一滴高锰酸钾溶液时,溶液变成浅紫色,且半分钟不恢复原色,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;当滴入最后一滴高锰酸钾溶液时,溶液变成浅紫色,且半分钟不恢复原色.
点评 本题考查物质制备实验,涉及物质分离和提纯、基本实验操作、滴定实验及计算等知识点,侧重分析与实验能力的考查,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L醋酸溶液中:c(H+)=c(CH3COO- )+c(OH- ) | |
| B. | 中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 | |
| C. | 由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4 | |
| D. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入少量稀H2SO4,在管口观察到红棕色气体 | 溶液中NO3-被Fe2+还原成NO2 |
| B | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 有NaHCO3晶体析出 |
| D | 常温下,将Al箔插入浓硫酸中,无明显现象 | 铝和浓硫酸常温不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )
“埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )| A. | 漂白粉、双氧水都可以杀灭埃博拉病毒 | |
| B. | 组成病毒的糖类、酯类和蛋白质在一定条件下都可发生水解反应 | |
| C. | 酯在酸性条件下的水解反应属于取代反应,也属于可逆反应 | |
| D. | 糖类和蛋白质的燃烧产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能与冷水剧烈反应,而铝不能与冷水反应 | |
| B. | NaOH易溶于水,Al(OH)3难溶于水 | |
| C. | 等物质的量的NaOH和Al(OH)3,Al(OH)3可以电离出更多OH- | |
| D. | 等物质的量铝比钠失去电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中离子浓度关系为:c (Na+)>c(HCO3-)>c (OH-)>c(H+) | |
| B. | 25℃时,加水稀释后,$\frac{c(O{H}^{-})}{c({H}^{+})}$变小 | |
| C. | 温度升高,c(OH-)×c(H+)不变(忽略体积变化) | |
| D. | 溶液中c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
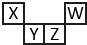 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )| A. | 最高正化合价:X<Y<Z | |
| B. | 原子半径:X<Y<Z | |
| C. | 气态氢化物的热稳定性:Z<W | |
| D. | 最高价氧化物对应水化物的酸性:X<Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com