
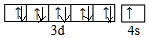 .
. (必须标明配位键).
(必须标明配位键).分析 A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大;A是元素周期表中原子半径最小的元素,则A为H元素;
非金属元素B原子的核外电子数是未成对电子数的3倍,则B是C元素;
D是地壳中含量最多的元素,则D为O元素,C原子的最外层p轨道的电子为半充满结构,且C原子序数大于B而小于D,所以C是N元素;
E位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同,为Cu元素;
(1)E是Cu元素,有29个电子,其3d、4s电子为Cu原子价电子;
(2)B、C、D分别是C、N、O元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)①根据价层电子对互斥理论确定微粒空间构型,形成配位键的条件是有空轨道和孤电子对;
②根据价层电子对互斥理论,价层电子对数=σ 键个数+孤对电子,据此确定杂化类型;共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个σ键两个π键;
(4)①晶体具有自范性,可通过X-射线衍射实验进行鉴别;
②由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸;
③立方NiO(氧化镍)晶体的结构域氯化钠相同,其中每个Ni周围有6个最近距离的氧原子,这些氧原子形成的空间构型为正八面体,根据均摊法计算晶胞中Ni、O原子数目,根据ρ=$\frac{M}{V}$计算体积,棱长=$\root{3}{V}$.
解答 解:A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大;A是元素周期表中原子半径最小的元素,则A为H元素;
非金属元素B原子的核外电子数是未成对电子数的3倍,则B是C元素;
D是地壳中含量最多的元素,则D为O元素,C原子的最外层p轨道的电子为半充满结构,且C原子序数大于B而小于D,所以C是N元素;
E位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同,为Cu元素;
(1)E是Cu元素,有29个电子,其3d、4s电子为Cu原子价电子,其价电子排布图为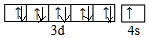 ,故答案为:
,故答案为: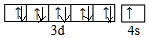 ;
;
(2)B、C、D分别是C、N、O元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)①氨气分子中,NH3中N原子成3个σ键,有一对未成键的孤对电子,价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,所以采取sp3杂化,空间构型是三角锥型;
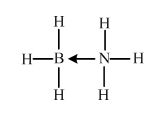
NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体,应含有18的电子,为BH3•NH3,Y是乙烯的等电子体,应为BH2=NH2,X中B含有空轨道,N含有孤电子对,可形成配位键,X的结构式为 ,
,
故答案为:三角锥形; ;
;
②由 可知,中心原子形成4个σ 键,为sp3杂化,Y是乙烯的等电子体,应为BH2=NH2,BH2=NH2中B和N都形成3个σ 键,为sp2杂化,BH2=NH2中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,
可知,中心原子形成4个σ 键,为sp3杂化,Y是乙烯的等电子体,应为BH2=NH2,BH2=NH2中B和N都形成3个σ 键,为sp2杂化,BH2=NH2中含有1个碳氮双键,含有1个π键,含有2个B-H键、2个N-H键,所以分子中σ键和π键数目之比为5:1,
故答案为:sp3和sp2;5:1;
(4)①晶体具有自范性,可通过X-射线衍射实验进行鉴别,某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于晶体,可通过X射线衍射方法鉴别,
故答案为:晶体;X射线衍射;
②由于异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键,所以硫氰酸(H-S-C≡N)的沸点低于异硫氰酸,
故答案为:异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键;
③立方NiO(氧化镍)晶体的结构域氯化钠相同,其中每个Ni周围有6个最近距离的氧原子,这些氧原子形成的空间构型为正八面体,晶胞中Ni原子数目为1+12×$\frac{1}{4}$=4,氧原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞体积=$\frac{\frac{(59+16)}{{N}_{A}}×4}{ρ}$cm3,棱长=$\root{3}{V}$=$\root{3}{\frac{\frac{(59+16)}{{N}_{A}}×4}{ρ}}$cm=$\root{3}{\frac{75×4}{ρ{N}_{A}}}$cm,
故答案为:6;正八面体;$\root{3}{\frac{75×4}{ρ{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及晶体结构与性质、核外电子排布、杂化轨道、晶胞计算等,难度中等,(4)为易错点,注意利用均摊法计算晶胞质量,根据阴阳离子所带电荷相等计算氧化镍晶体中离子数目之比,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:填空题
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号[ | H | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)该反应的离子方程式为____________________________;
(2)探究温度对化学反应速率影响的实验编号是 ,探究反应物浓度对化 学反应速率影响的实验编号是 ;
学反应速率影响的实验编号是 ;
(3)实验①测得K MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
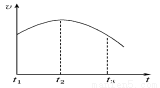
(4)该反应的速率v和时间t的关系如图所示,在t1~t2时段反应速率________(填“加快”或“减慢”或“变化不明显”),主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
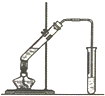 Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.
Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
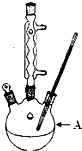 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)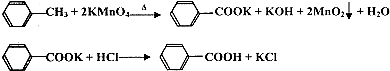
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
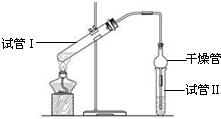 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 分子直径/nm | 分子与H2O的结合能E/kJ•mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
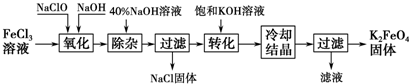
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热一定是强酸跟强碱反应放出的热量 | |
| B. | 1 mol酸与1 mol碱完全反应放出的热量是中和热 | |
| C. | 在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l)△H=57.3KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com