
| 1g |
| 17g/mol |
| 1 |
| 17 |
| 2670.9 |
| 3 |
| 1g |
| 17g/mol |
| 1 |
| 17 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
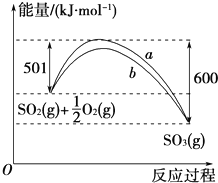 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时仰视刻度线 |
| B、未等溶液冷却至室温就进行定容 |
| C、转移溶液后,未洗涤烧杯和玻璃棒 |
| D、溶液在引流时溅出容器外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CH2OH+CH3COOH
| |||
B、CH2=CH2+HOCl
| |||
C、2CH3CH2OH+O2
| |||
D、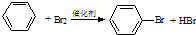 加成反应 加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com