
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| △c |
| △t |
| ||
| 5s |
| ||||
|
| ||||
|


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
 意大利罗马大学的Fuluio Cacace等人获得了极具有理论研究意义的气态N分子,其分子结构如图所示,已知断裂1molN-N吸收167KJ的热量,生成1molN≡N放出942KJ热量,根据上述信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fuluio Cacace等人获得了极具有理论研究意义的气态N分子,其分子结构如图所示,已知断裂1molN-N吸收167KJ的热量,生成1molN≡N放出942KJ热量,根据上述信息和数据,判断下列说法正确的是( )| A、N4属于一种新型化合物 |
| B、N4晶体熔点高,硬度大 |
| C、相同质量的N4的能量高于N2 |
| D、1molN4转变为N2将吸收882KJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6mol/L |
| B、9.2mol/L |
| C、10.8mol/L |
| D、5.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5种 | B、6种 | C、8种 | D、9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
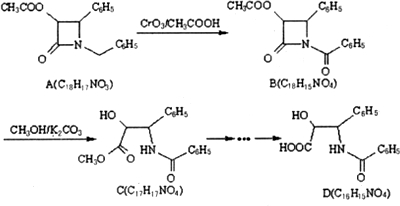
| K2CO3 |
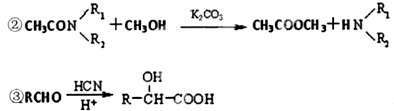
| PCl3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
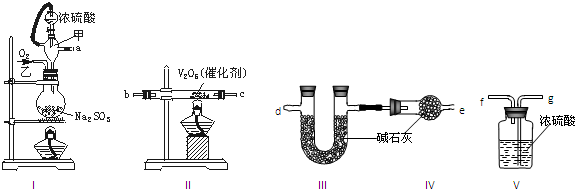
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁是地壳中含量最多的金属元素 |
| B、铁是人类使用最早的金属 |
| C、纯铁是银白色金属 |
| D、铁能在氧气中燃烧,但不能与高温水蒸气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离乙醇和碘的混合物 | CCl4萃取 | 碘在CCl4中溶解度较大 |
| B | 除去CO2中的SO2 | NaOH溶液洗气 | SO2能与NaOH反应 |
| C | 除去氧化钙中的碳酸钙 | 水,过滤 | 碳酸钙不溶于水 |
| D | 分离碘和苯的混合物 | 蒸馏 | 苯蒸气冷凝回收苯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com