
| A. | 镀锡铁制品镀层破损后铁不易被腐蚀 | |
| B. | 相同温度下,pH相同的盐酸和硫酸中水的电离程度相同 | |
| C. | 向饱和石灰水中滴加少量CuC12溶液出现蓝色沉淀,则Ksp[Ca(OH)2]<Ksp[Cu(OH)2] | |
| D. | 合成氨生产中,需将NH3液化分离,目的是加快正反应速率,并提高H2转化率 |
分析 A、镀锡铁制品的镀层破损后,铁做负极,锡做正极;
B、pH相同的盐酸和硫酸溶液中,氢离子浓度相同,对水的电离的抑制程度相同;
C、向饱和石灰水中滴加少量CuC12溶液出现蓝色沉淀,则说明氢氧化铜的Ksp更小;
D、合成氨的过程中,将氨气液化分离后,氨气的浓度变小.
解答 解:A、镀锡铁制品的镀层破损后,铁做负极,锡做正极被保护,故铁更易被腐蚀,故A错误;
B、pH相同的盐酸和硫酸溶液中,氢离子浓度相同,对水的电离的抑制程度相同,故两溶液中水的电离程度相同,故B正确;
C、向饱和石灰水中滴加少量CuC12溶液出现蓝色沉淀,则说明氢氧化铜的溶解度更小,即Ksp更小,即有Ksp[Ca(OH)2]>Ksp[Cu(OH)2],故C错误;
D、合成氨的过程中,将氨气液化分离后,氨气的浓度变小,则逆反应速率变小,则正反应速率也变小,平衡右移,则氢气的转化率提高,故D错误.
故选B.
点评 本题考查了金属的腐蚀、酸碱对水的电离的影响以及分离生成物对反应速率和平衡的影响,应注意的是在合成氨的反应中,将氨气分离后,正逆反应速率均减小,平衡右移.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
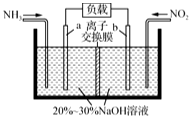 利用所学化学知识解答下列问题:
利用所学化学知识解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用KI鉴别淀粉溶液和Na2CO3溶液 | |
| B. | 隔夜蔬菜中的部分硝酸盐被氧化为有毒的亚硝酸盐 | |
| C. | 沾附水滴的铁质餐具生锈是化学腐蚀所致 | |
| D. | 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中通入CO2至溶液为中性,则$\frac{c(N{a}^{+})}{2c(C{O}_{3}^{2-})}$>1 | |
| B. | pH相同的氨水和Ba (OH)2溶液中:2c (NH4+)=c ( Ba2+) | |
| C. | 等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH-)-c(H+)=c(HSO3-)+c(H2SO3) | |
| D. | 向Mg (OH)2浊液中加入少量NH4Cl粉末$\frac{c(M{g}^{2+})}{c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
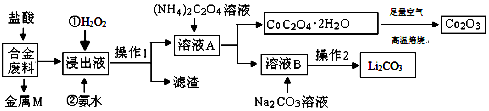
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验过程 | 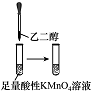 | 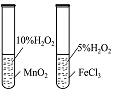 | 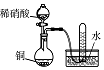 |  |
| 实验目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
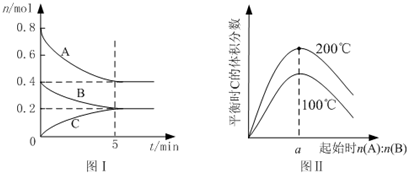
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)+Q(Q>0) | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 由图I可知,该反应式为2A(g)+B(g)?C(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com