
【题目】人类对于晶体结构的持续探究揭开了晶体内部的奥秘,并合成了许许多多的新物质、新材料。回答下列问题:
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
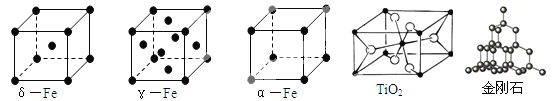
(2)TiO2的天然晶体中,最稳定的一种晶体结构如上图,白球表示: 原子。
(3)NaCl、CO2、SiO2三种晶体熔点由低到高的顺序是 。
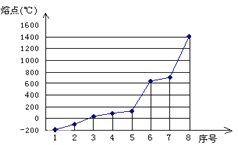
(4)第三周期八种元素按单质熔点由低到高的顺序排列如图所示,其中序号1和8分别代表的是 和 。
(5)已知:Cr3+可形成配位数为6的配合物。组成为CrCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 (选填代号)。
A.[CrCl(H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]·3H2O
(6)根据下表所示键能,写出金刚石(结构如上图)完全燃烧时的热化学方程式 。
【答案】
(1)4 4:3
(2) 氧
(3) CO2、NaCl、SiO2
(4) Ar、Si
(5) B
(6) ![]()
【解析】
试题分析:(1)铁有δ、γ、α三种同素异形体,根据均摊原则,γ晶体晶胞中所含有的铁原子数为![]() =4,δ、α两种晶胞中铁原子的配位数分别是8、6之比为4:3。
=4,δ、α两种晶胞中铁原子的配位数分别是8、6之比为4:3。
(2)TiO2的天然晶体中,最稳定的一种晶体结构如上图,根据均摊原则,黑球的个数是 ![]() =2,白球的个数是
=2,白球的个数是![]() 4,黑球与白球的比是1:2,所以白球表示:氧原子。
4,黑球与白球的比是1:2,所以白球表示:氧原子。
(3)NaCl是离子晶体、CO2是分子晶体、SiO2是原子晶体,三种晶体熔点由低到高的顺序是CO2、NaCl、SiO2。
(4)根据沸点氩是气体,沸点最低,硅是原子晶体,沸点最高,其中序号1和8分别代表的是Ar和Si。
(5)分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1,说明外围氯离子的比为3:2:1, 绿色样品只有1个氯离子。则绿色配合物的化学式为[CrCl2(H2O)4]Cl·2H2O。
(6)焓变等于反应物的总键能-生成物的总键能, 1mol金刚石含有2mol碳碳单键,1mol金刚石燃烧时的热化学方程式![]() 。
。


科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的物质资源和能量宝库,世界各国都在研究如何充分利用海洋资源。
Ⅰ. 从海水中可以提取食盐。
Ⅱ.从海水中提取镁。已知MgO、MgCl2的熔点分别为2800℃、604℃,从海水中提
取镁,最合理的方法是 。
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→MgCl2熔融
MgCl2溶液→MgCl2熔融![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2熔融
MgCl2溶液→MgCl2熔融![]() Mg
Mg
Ⅲ.从海水中提溴。其工业方法有:空气吹出纯碱吸收法、空气吹出SO2吸收法、溶
剂萃取法等。
(1)空气吹出纯碱吸收法。将氯气通入富含溴离子的海水中,再用空气将溴吹出,
用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质.该方法涉及的反应有:
① (写出离子方程式);
②3Br2+3CO32﹣═BrO3﹣+5Br﹣+3CO2↑;
③BrO3﹣+5Br﹣+6H+═3Br2+3H2O
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,
然后再用氯气氧化即得单质溴。
写出溴与二氧化硫反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从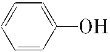 合成
合成 (部分试剂盒反应条件已略去):
(部分试剂盒反应条件已略去):
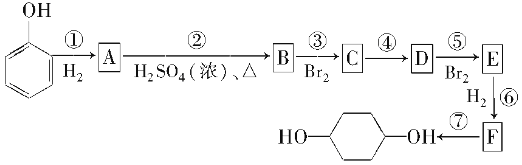
请回答下列问题:
(1)分别写出B、D的结构简式:
B.__________________________________________________,
D.__________________________________________________。
(2)反应①~⑦中属于消去反应的是_________。属于还原反应的是 (填反应代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到E的可能的结构简式为: ____________________________________________________。
(4)试写出C―→D反应的化学方程式(有机物写结构简式,并注明反应条件)。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:(填写时用对应元素符号或物质的化学式)
(1)五种元素原子中基态时未成对电子数最多的是 。
(2)基态原子Y的轨道表示式是:![]()
(3)基态原子Z的电子排布式是 。向Z的硫酸盐溶液中加入过量氨水时反应的离子方程式是 ,所得产物中含Z元素在内的离子的结构示意图是:(不考虑空间构型,如有配位键,请标出)
(4)Q、R、X的电负性由小到大的顺序是 。
(5)Q、X和Y的氢化物稳定性由小到大的顺序为 。
(6)在一定条件下,原子的核外电子从激发态跃迁到基态产生的光谱属于 光谱(填“吸收”或“发射”),该光谱可用于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为探究金属与浓硫酸反应,进行了如下实验。
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示。(固定装置已略去)
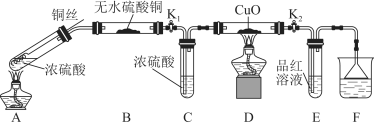
(1)A中反应的化学方程式为 。
(2)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是 。
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(3)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是__________________;
(4)某同学用下列装置连接成一整套实验装置以验证(3)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________________(用a、b……填写)。
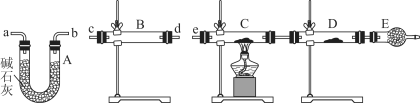
(5)根据(4)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:

①___________________________________________________________________________
②___________________________________________________________________________
③___________________________________________________________________________
④___________________________________________________________________________
⑤___________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42)中提取铬.

有关数据如表:
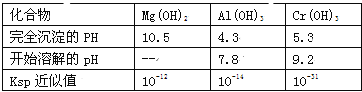
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO47H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。当溶液Ph=5时,c(Cr3+)=__________
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)

(6)步骤⑦发生的化学反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
① 金刚石与石墨; ② 氧气(O2)与臭氧(O3);
③ 16O、17O和18O; ④ CH4和CH3CH2CH3;
⑤ 乙烯和乙烷;
⑥![]() 和
和![]() ; ⑦
; ⑦![]() 和
和 ;
;
(1)同位素 ,(2)同素异形体 ,
(3)同系物 ,(4)同分异构体 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
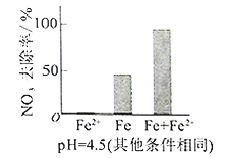
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿润的淀粉碘化钾试纸接触某气体而显蓝色,该气体可能是①Cl2 ②NO2 ③H2S ④SO2 ⑤溴蒸气 ⑥HCl中的 ( )
A.①④⑤ B.①②⑤ C.①②⑥ D.①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com