
| A.化学反应的本质是有新物质的生成 |
| B.元素性质的周期性变化是由核外电子排布的周期性变化引起的 |
| C.原电池是将化学能转化为电能的装置 |
| D.利用HCl和NaOH的反应可以设计成原电池 |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:不详 题型:计算题
 (1分)铜锌原电池的总反应的离子方程式为:________________________________________________________________________
(1分)铜锌原电池的总反应的离子方程式为:________________________________________________________________________查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.I和III | B.I和IV |
| C.II和III | D.II和IV |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是
Ag + Fe3+设计成如下图所示的原电池。下列判断错误的是
| A.反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B.电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C.电流计读数为零后,在甲中加入FeCl3固体,乙中石墨电极反应为Ag - e- ="=" Ag+ |
| D.电流计读数为零后,在乙中加入硫化钠固体,电流计指针读数仍为零 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
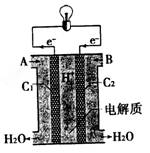

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲中负极反应式为:2H++2e-=H2↑ | B.乙中阳极反应式为:Ag++e-="=" Ag |
| C.丙中H+向碳棒方向移动 | D.丁中电解开始时阴极产生黄绿色气体 |
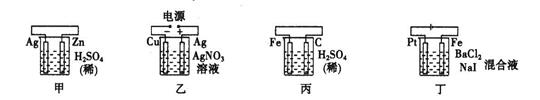
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com