
【题目】25℃时,在25mL 0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2mol·L-1 CH3COOH溶液,溶液的pH变化曲线如图所示,下列分析结论正确的是( )
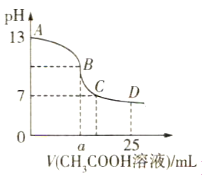
A.若B点的横坐标a=12.5,则有c(Na+)=c(CH3COO-)
B.对曲线上A、B间任意一点,溶液中都有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
D.C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
【答案】D
【解析】
A. 若B点的横坐标a=12.5,则NaOH与CH3COOH刚好完全反应,生成CH3COONa和水,由于CH3COO-发生水解,使得c(CH3COO-)减小,所以c(Na+)>c(CH3COO-),A错误;
B. 靠近B点的位置,溶液中的溶质主要为CH3COONa,此时c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B错误;
C. D点时,CH3COONa与CH3COOH物质的量相等,浓度相等,即便考虑CH3COOH电离,一定有下列关系:c(CH3COO-)+c(CH3COOH)=2c(Na+),C错误;
D. C点时,溶液为CH3COONa与CH3COOH的混合溶液,因为pH=7,所以可认为醋酸不电离,醋酸根离子不水解,从而得出:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
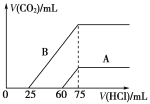
(1)原NaOH溶液的物质的量浓度为____________mol/L。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是____________,其物质的量之比为__________。
(3)曲线B表明,所得溶液加盐酸后产生CO2气体体积(标况)的最大值为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属于同一族,它们原子的最外层电子排布式为ns1。B和D也属于同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是____,B是____,C是_____,D是____,E是____。
(2)由这五种元素组成的一种化合物是(写化学式)____。写出该物质的一种主要用途:____。
(3)写出C元素基态原子的电子排布式:___。
(4)用电子排布图表示D元素原子的外围电子排布为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 2.00 | 0.00 |
1 | 0.90 | 1.80 | 0.20 |
3 | 0.75 | 1.50 | 0.50 |
5 | 0.65 | 1.30 | 0.70 |
9 | 0.55 | 1.10 | 0.90 |
10 | 0.55 | 1.10 | 0.90 |
14 | 0.55 | 1.10 | 0.90 |
(1)体系中发生反应的化学方程式____________;
(2)列式计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3)该反应达到平衡时反应物X的转化率α等于________;
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1____________,2______________,3______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出-套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
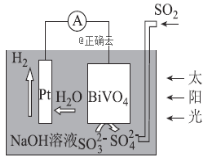
A.该电化学装置中,Pt电极作正极
B.BiVO4电极上的反应式为![]()
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.OH-移向BiVO4电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温下的密闭容器中,有可逆反应![]() ,下列不能说明该反应已达到平衡状态的是( )
,下列不能说明该反应已达到平衡状态的是( )
A.正反应生成NO2的速率和逆反应生成O2的速率
B.混合气体的颜色不再改变
C.反应容器中的压强不随时间的变化而变化
D.混合气体的平均摩尔质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是( )
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. Y、Q形成的化合物是强电解质
C. W、X、Q三种元素都能形成多种氧化物
D. 电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com