
 CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。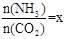 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。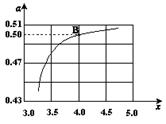
 CO(NH2)2(l)+H2O(l)知,参加反应的氨气为1.00mol,NH3的平衡转化率为25%;(4)根据题给信息及氧化还原方程式的书写原则写出该反应的化学方程式为:12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl 。
CO(NH2)2(l)+H2O(l)知,参加反应的氨气为1.00mol,NH3的平衡转化率为25%;(4)根据题给信息及氧化还原方程式的书写原则写出该反应的化学方程式为:12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl 。

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:不详 题型:单选题
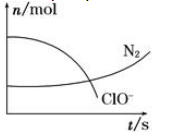
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO- , 还原产物是HCO3- |
| C.配平后氧化剂与还原剂的化学计量数之比为5∶2 |
| D.若生成2.24 L N2(标准状况),则转移电子0.5 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应中消耗的Zn的质量为97.5 g |
| B.气体A中SO2和H2的体积比为1∶4 |
| C.反应中被还原的元素只有一种 |
| D.反应中共转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO Pb+CO2。
Pb+CO2。| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
| D.将l mol PbS完全冶炼成Pb理论上至少需要6 g碳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可以计算出混合气体中CO2和水蒸气的质量 |
| B.可以判断出混合气体的平均摩尔质量 |
| C.可以计算出该反应中转移的电子数 |
| D.可以总结出Na2O2任何反应中既作氧化剂也作还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com