
| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
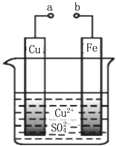
| A. | a和b不连接时,铁片上有红色的铜析出,该装置不能形成原电池 | |
| B. | a和b用导线连接时铜片为负极,发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成 | |
| D. | a和b用导线连接时,溶液中的Cu2+应向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X中肯定存在Na+、NH4+、Fe2+、Al3+、SO42- | |
| B. | 气体F经催化氧化可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH)3 | |
| D. | X中不能确定的离子是Al3+、Na+、K+和Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 10 mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
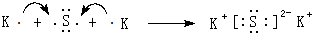 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,与N3-互为等电子体的分子为N2O(写一种);
,与N3-互为等电子体的分子为N2O(写一种);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
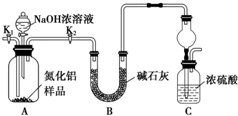
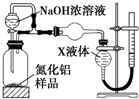
 d.NH4Cl溶液
d.NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com