
下列说法正确的是
A. 用直接加热并蒸干FeCl3溶液的方法可制得纯净的无水FeCl3
B. 等物质的量浓度的Na2CO3溶液和CH3COONa溶液的pH,前者大于后者
C. 中和等体积、等物质的量浓度的盐酸和醋酸溶液,消耗NaOH的物质的量不相等
D. 对于有气体参加的反应,增大气体反应物浓度,活化分子百分数增大,反应速率加快
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源:2017届四川省高三上学期第四次月考理科综合化学试卷(解析版) 题型:推断题
A是一种重要的化工原料,已知A是一种卤代烃,相对分子质量为92.5,其核磁共振氢谱中只有一个峰,C是一种高分子化合物,M是一种六元环状酯,转化关系如图所示,回答下列问题:
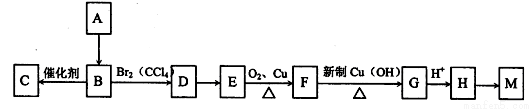
(1)A的分子式为_____;A→B的反应类型___;
(2)写出结构简式:D __,M的结构简式为___。
(3)写出下列反应的化学方程式:B→C:_____________;E→F_________________。
(4)满足下列条件的H的同分异构体共有__________种。写出其中一种同分异构体的结构简式______。
①属于酯类; ②能发生银镜反应; ③能与金属钠反应放出气体。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一下学期第一次月考化学试卷(解析版) 题型:选择题
a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是
A. (b-2a)mol B. 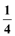 b mol C.
b mol C.  a mol D. 2a mol
a mol D. 2a mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:简答题
环境监测显示,某地市的主要气体污染物为SO2,NOx,CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式______;
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g) 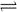 2NO(g) △H>0
2NO(g) △H>0
①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=_______(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时问内NO排放最越大,原因是______________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
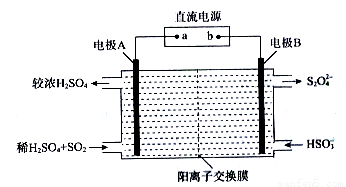
①电极A的电极反应式为________________;电极B的电极反应式为_____________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-,Br-,CrO4-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A. Cl-、Br-、CrO4- B. Br-、Cl-、CrO4- C. CrO4-、Br-、Cl- D. Br-、CrO4-、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是
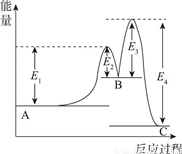
A. 两步反应的ΔH均大于0 B. 加入催化剂能改变反应的焓变
C. 三种物质中C最稳定 D. A→C反应的ΔH=E4-E1
查看答案和解析>>
科目:高中化学 来源:2017届江西省南昌市高三第一次模拟考试理综化学试卷(解析版) 题型:简答题
太阳能电池板材料除单品硅外,还有铜、铟、稼、硒、硅等化学物质。
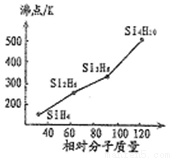
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____Si(填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷(SinH2n+2)。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是______________。
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________。
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为___________________。
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度_____g/cm3。
(3)稼的基态原子的电子排布式是_______。与铟、稼元家处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物.如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______,B与N之间形成______键;硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.其电离方程式为______________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省濮阳市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示。下列说法正确的是
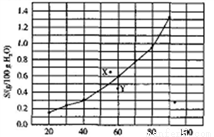
A. 溴酸银的溶解是一个熵增、焓减过程
B. 对应温度下,X点的分散系中,V(溶解)>v(沉淀)
C. Y点的分散系中,c(Ag+)·c(BrO3-)>6.25×10-4
D. 60 ℃时溴酸银饱和溶液中c(BrO3-)=0.025mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届海南省琼海市高三下学期第一次月考化学试卷(解析版) 题型:填空题
X、Y、Z、W四种短周期元素在周期表中的位置关系如右图所示,其中Z元素原子的最外层电子数是其电子层数的2倍。
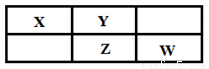
请回答下列问题:
(1)元素Z位于周期表中第_______周期,________族;
(2)这些元素的最高价氧化物对应的水化物中,水溶液酸性最强的是_______(写化学式);
(3)Y和Z组成的化合物的化学式为_______;
(4)W的单质和过量的X的氢化物可发生氧化还原反应,所得两种产物的电子式分别为____________、___________;
(5)W的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol 电子转移时,共产生9 mol 气体,写出该反应的化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com