
【题目】可以将氧化还原反应2H2+O2![]() 2H2O设计成原电池。
2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,电极反应式为:正极_________,负极______________。
(2)如果把KOH改为稀硫酸作电解质,则电极反应式为:正极:____________。
(3)(1)和(2)的电解质溶液不同,反应进行后,其溶液的pH各有何变化?__________。
(4)如把H2改为甲烷,KOH溶液作电解质溶液,则电极反应式为:正极:__________,负极:__________。
【答案】O2+2H2O+4e-=4OH- 2H2+4OH--4e-=4H2O O2+4H++4e-=2H2O 前者变小,后者变大 2O2+4H2O+8e-=8OH- CH4+10OH--8e-=CO32-+7H2O
【解析】
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,正极的电极反应式为O2 + 2H2O + 4e- =4OH-,负极的电极反应式为:2H2 - 4e- + 4OH- =4H2O;
(2)若把KOH改为稀硫酸作电解质,正极的电极反应式为O2 + 4H+ + 4e- =2H2O,负极的电极反应式为:2H2 - 4e-=4H+;
(3)利用该反应2H2+O2![]() 2H2O设计的原电池,都生成水,因此电解质溶液浓度减小;
2H2O设计的原电池,都生成水,因此电解质溶液浓度减小;
(4)如把H2改为甲烷,KOH溶液作电解质溶液,则电极反应式为:正极: 2O2+4H2O+8e-=8OH-;负极:CH4+10OH--8e-=CO32-+7H2O。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,氢气在负极失电子发生氧化反应,氧气在正极得电子发生还原反应,正极的电极反应式为O2 + 2H2O + 4e- =4OH-,负极的电极反应式为:2H2 - 4e- + 4OH- =4H2O;
故答案为:O2+2H2O+4e-=4OH-;2H2+4OH--4e-=4H2O;
(2)若把KOH改为稀硫酸作电解质,正极的电极反应式为O2 + 4H+ + 4e- =2H2O,负极的电极反应式为:2H2 - 4e-=4H+;
故答案为:O2+4H++4e-=2H2O;
(3)利用该反应2H2+O2![]() 2H2O设计的原电池,都生成水,因此电解质溶液浓度减小,氢氧化钾溶液浓度减小,pH变小,稀硫酸浓度减小,pH变大;
2H2O设计的原电池,都生成水,因此电解质溶液浓度减小,氢氧化钾溶液浓度减小,pH变小,稀硫酸浓度减小,pH变大;
故答案为:前者变小,后者变大;
(4)如把H2改为甲烷,KOH溶液作电解质溶液,甲烷在负极失电子发生氧化反应,氧气在正极得电子发生还原反应,则电极反应式为:正极: 2O2+4H2O+8e-=8OH-;负极:CH4+10OH--8e-=CO32-+7H2O;
故答案为:2O2+4H2O+8e-=8OH-;CH4+10OH--8e-=CO32-+7H2O。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是( )
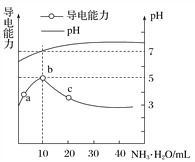
A. HR为强酸 B. a、b两点所示溶液中水的电离程度相同
C. b点溶液中c(NH![]() )>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
)>c(R-)、c(OH-)>c(H+) D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为:7.1×10-6,2.98×10-9。HNO2的酸性比HClO_______(填“强”、“弱”);将0.1mol/L的亚硝酸加水稀释100倍,c(H+)_______(填“不变”、“增大”或“减小”),Ka值________(同上)
(2)NaNO2与NaCl都是白色粉末且都有咸味,但NaNO2有毒,具有致癌性。通常它们可以通过加入热的白醋(CH3COOH)鉴别,NaNO2遇到白醋会产生一种红棕色气体和一种无色气体,它们的组成元素相同。该反应的离子方程式为____________。
(3)磷及部分重要化合物的相互转化如图甲所示。

①“步骤Ⅰ”为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,焦炭的作用是__________。
②不慎将白磷沾到皮肤上,可用0.2mol/LCuSO4溶液冲洗,“步骤Ⅱ”涉及的反应中氧化剂是_________。
(4)若处理后的废水中c(PO43-)=4×10-7mol/L,则溶液中c(Ca2+)不会超过________mol/L。(Ksp[Ca2(PO4)3]=2×10-29)
(5)某“液氨—液氧”燃料电池装置示意图如图乙所示,该燃料电池以NaOH为电解质。该电池在工作时,“电极2”为_______极(填“正”或“负”);“电极1”表面发生的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:
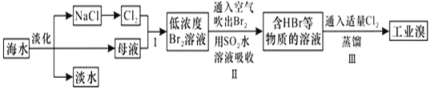
A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用已知物质的量浓度的NaOH测定未知物质的量浓度的盐酸,将20.00 ![]() 待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
实验编号 |
| 滴定完成时, | 待测盐酸的体积/ |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
① 滴定达到终点的标志是____________________________。
② 根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
③ 排除碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A. 滴定终点读数时俯视
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 称量的![]() 固体中混有
固体中混有![]() 固体
固体
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某5L溶液只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气味气体和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示。用该淡黄色物质做焰色反应,火焰呈黄色。
请回答下列问题:

(1)生成气体的曲线是_____(填“Ⅰ”或“Ⅱ”)。
(2)ab段发生反应的离子方程式为_____________________。
(3)原溶液中所含阳离子为___。(填离子符号)阴离子浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓![]() 中组成原电池
中组成原电池![]() 图
图![]() ,测得原电池的电流强度
,测得原电池的电流强度![]() 随时间
随时间![]() 的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是
的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是
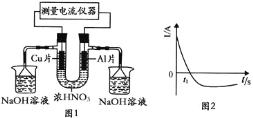
A.![]() 时刻前,Al片的电极反应为:
时刻前,Al片的电极反应为:![]()
B.![]() 时,因Al在浓硝酸中钝化,氧化膜阻碍了Al继续反应
时,因Al在浓硝酸中钝化,氧化膜阻碍了Al继续反应
C.![]() 之后,正极Cu失电子,电流方向发生改变
之后,正极Cu失电子,电流方向发生改变
D.烧杯中NaOH溶液的作用为吸收![]() ,防止污染空气
,防止污染空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)= CH3OH(g),在体积为1L的恒容密闭容器中,充入2 molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
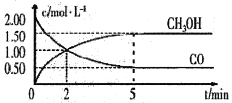
①从反应开始至达到平衡,用氢气表示的平均反应速率υ(H2)=_______mol/(L·min)
②下列说法正确的是______(填字母序号)。
A.达到平衡时,CO的转化率为75%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
③该条件下反应的平衡常数K=______。
(2)已知:I.CO的燃烧热为△H=-283.0kJ·mol-1
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1
III.2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
则①2CH3OH(g)+CO(g)+![]() O2(g)
O2(g)![]() CH3OCOOCH3(g)+ H2O( l) △H=_____。
CH3OCOOCH3(g)+ H2O( l) △H=_____。
②对于可逆反应2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH![]() 3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
(4)若往20mL0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______(填序号)。
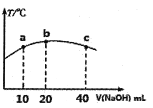
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com