
| A. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 | |
| B. | 常温常压下,足量的Fe在1 mol Cl2中充分燃烧,转移的电子数为2NA(NA为阿伏加德罗常数的值) | |
| C. | 卤族元素单质X2(X:代表F、Cl、Br、I)均可以与水反应生成HXO | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 |
分析 A.在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性;
B.Cl2氧化性强,与Fe反应生成三价铁;
C.F2氧化性很强,与水反应生成HF和O2;
D.两性氧化物是指:既能与酸又能与碱反应,只生成盐和水的氧化物.
解答 解:A.因为Fe3+与铜反应生成Cu2+,Cu2+与锌反应生成Zn2+,根据氧化剂的氧化性强于氧化产物的氧化性,则溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱,故A正确;
B.Cl2氧化性强,与Fe反应生成三价铁,所以足量的Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA,故B错误;
C.F2氧化性很强,与水反应生成HF和O2,故C错误;
D.氢氟酸与二氧化硅反应生成四氟化硅和水,不符合两性氧化物的定义,不是两性氧化物,故D错误;
故选:A.
点评 本题考查氧化还原反应的判断及其两性氧化物的定义,为高频考点和常见题型,侧重于学生的分析能力的考查,答题注意把握物质的性质,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
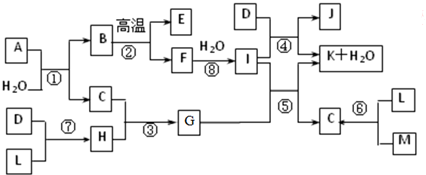
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏?????????? | B. | 萃取、蒸馏、分液 | ||
| C. | 分液、蒸馏、萃取????????? | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
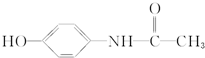 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 该有机物属于α-氨基酸 | |
| C. | 该有机物属于α-氨基酸的同分异构体有3种 | |
| D. | 该有机物与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
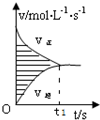 在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )
在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )| A. | 反应起始时,X、Y、Z 三种物质同时存在 | |
| B. | t1 时刻,X、Y、Z 浓度不再发生变化,反应停止 | |
| C. | 若该反应在更大的压强下进行,达平衡时,阴影部分面积不变 | |
| D. | 若该反应在加入催化剂的条件下进行,达平衡时,阴影部分面积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 18 g重水(D2O)所含的电子数为10NA | |
| C. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
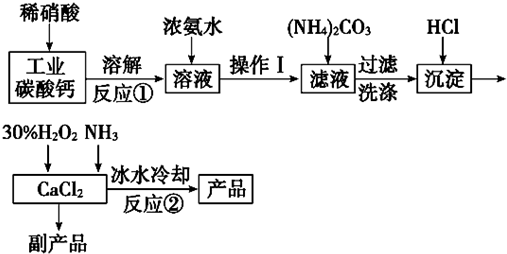
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com