
软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下:
(1)I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式: ;
(2)已知Fe(OH)3、Al(OH)3、Zn(OH)2三种物质开始沉淀和完全沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.6 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |

(16分)
(1)MnO2 + CuS+ 2H2SO4 ="S" + MnSO4 + CuSO4+2H2O(3分)
(2)Fe(OH)3、Al(OH)3(各1分) 将Fe2+氧化成Fe3+(2分)
(3)趁热过滤(2分) 防止形成 Na2SO4·10H2O(2分)
(4)Mn2+—2e-+2H2O = MnO2+4H+(3分)
(5)Zn、H2SO4(各1分)
解析试题分析:(1)依题意,MnO2、CuS、H2SO4反应生成MnSO4、CuSO4、S、H2O,锰元素由+4降为为+2价,硫元素由—2升为0价,根据最小公倍数法配平,则该反应为MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O;(2)根据表中信息,若溶液pH调至5.2~5.4,则溶液中的铁离子、铝离子都被完全除去,分别变为氢氧化铁沉淀、氢氧化铝沉淀,所以沉淀M的成分为Fe(OH)3、Al(OH)3;II中加入适量Zn,充分反应后过滤,得到Cu,由此推断发生的反应为Zn+Cu2+=Zn2++Cu、Cu+2Fe3+=Cu2++2Fe2+,则II的滤液中无铁离子,只有亚铁离子,为了将亚铁离子除去,需要先将其氧化为铁离子,再调节溶液pH将其完全变为氢氧化铁沉淀,因此III中加入的二氧化锰是将Fe2+氧化成Fe3+的氧化剂,即MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(3)读图,硫酸钠的溶解度随温度降低逐渐增大,而十水硫酸钠的溶解度随温度降低明显减小,由此说明从IV溶液中制取硫酸钠固体的方法是蒸发浓缩、趁热过滤、洗涤、干燥,而制取十水硫酸钠固体的方法是蒸发浓缩、冷却结晶、洗涤、干燥;用乙醇洗涤硫酸钠固体时,不会析出十水硫酸钠,用水洗涤硫酸钠固体时,随着温度的降低,硫酸钠溶解度增大,容易洁净析出十水硫酸钠固体;(4)电解前,V溶液中含有锌离子、锰离子,由此推断电解时锌元素由+2降为0价,得到电子,发生还原反应,说明Zn是阴极产物;锰元素由+2升为+4价,失去电子,发生氧化反应,说明二氧化锰是阳极产物,即Mn2+—2e-→MnO2;左边带4个正电,右边不带电,呈酸性的V溶液中只能用氢离子使左右电荷守恒,则Mn2+—2e-→MnO2+4H+;左边比右边少4H、2O,根据原子个数守恒可得阳极反应式:Mn2+—2e-+2H2O=MnO2+4H+;(5)根据流程图中主要步骤的反应物和生成物推断,V的生成物有二氧化锰、锌、硫酸,它们分别是III、II、I的反应物,IV产生的碳酸锌是III的反应物,它们都可以循环利用。
考点:考查物质制备的化学工艺流程,涉及氧化还原反应方程式的配平、滤渣的成分、解释加入试剂的目的、根据溶解度曲线推断制取晶体的操作方法、解释采取某措施的原因、阳极反应式、可以循环利用的物质等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下图是一套实验制取气体的装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是
| A.铜屑和稀硝酸 | B.碳酸钙和稀盐酸 |
| C.二氧化锰和浓盐酸 | D.氧人钙和浓氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨化铁是常见的水处理剂,无水晶 易升华。工业上制备无水的
易升华。工业上制备无水的 的一种工艺如图所示:
的一种工艺如图所示:
(1)加入吸收塔的吸收剂X应是 (填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5mL饱和FeCl3溶液滴入50mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为 ,胶体粒子的直径一般不超过 。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入 且保持过量,然后进行的操作依次为 、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为 。
(5)铁铬氯化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+ Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高锰酸钾在实验室和医疗上有非常广泛的应用。以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程: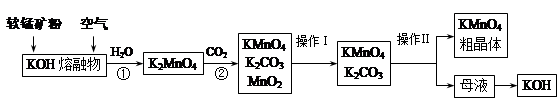
(1)上述生产过程中,第①步的氧化剂为(写化学式) 。
(2)第②步反应的化学方程式是 。
(3)由母液制得KOH应加入的物质是 。写出相应化学方程式 。
(4)操作Ⅰ用到的仪器有 ,操作Ⅱ是根据KMnO4和K2CO3两种物质在 上的差异,采用蒸发结晶、趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜是一种重要的金属元素,位于元素周期表第ⅠB族,+1价的铜与氯离子结合的生成的CuCl是一种难溶物质,但它可与过量的Cl-形成可溶于水的络离子[CuCl2]-。含铜最丰富的天然资源是黄铜矿(CuFeS2)。
(1)目前有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高。其主要流程如下:
①请完成反应Ⅰ中FeCl3与CuFeS2反应的化学方程式:
CuFeS2 + FeCl3 = +4 + 2S。
②写出反应Ⅳ中发生反应的离子方程式:
。
③反应Ⅲ是FeCO3在空气中煅烧,其化学方程式是
。
④已知Cu+在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu。则反应Ⅴ所得溶液A中含有的溶质有 。
(2)传统工艺从黄铜矿冶炼粗铜的技术,是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。与上面湿法冶炼技术方法比较,新方法的优点是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体又可用于验证物质的性质。请回答下列问题:
(1)利用装置Ⅰ制取气体,生成气体的反应应具备的条件是 。
(2)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是:
_______________________________________________________________________;
乙同学认为:对装置Ⅱ做简易改进(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 ;不能收集NO2气体的原因是(用化学方程式表示) ;
(3)利用装置Ⅰ、Ⅲ 验证物质的性质(K2打开,K1关闭)。如要设计实验证明氧化性
KMnO4>Cl2>Br2,则可在A 中加浓盐酸,B中加 ,C中加 ,观察到C中的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: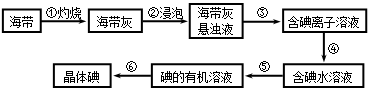
37. 步骤③的实验操作名称是_____________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_____________。
38. 步骤④需加入的试剂是________,反应的离子方程式是____________________。
39. 步骤⑤中,某学生选择用苯来提取碘,理由是_______________________________,
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下: 
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com