
分析 根据n=$\frac{m}{M}$可知,质量相等时物质的量与摩尔质量成反比;根据二者的物质的量之比及含有氧原子数目计算出所含氧原子的物质的量之比;氧元素的质量相等时,则氧原子的物质的量相等,结合二者组成计算出其物质的量之比,再计算出其质量之比.
解答 解:相同质量的SO2和SO3的物质的量之比与其摩尔质量成反比,则二者的物质的量之比为:80g/mol:64g/mol=5:4,所含氧原子的物质的量之比为:(5×2):(4×3)=5:6;
欲使SO2和SO3中氧元素的质量相等,则二者分子中含有的氧元素的物质的量一定相等,则SO2和SO3的物质的量之比为:$\frac{1}{2}$:$\frac{1}{3}$=3:2,二者的质量之比=(3×64):(2×80)=6:5,
故答案为:5:4;5:6;6:5.
点评 本题考查物质的量的计算,题目难度中等,明确物质的量与摩尔质量、阿伏伽德罗常数等之间的关系为解答关键,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
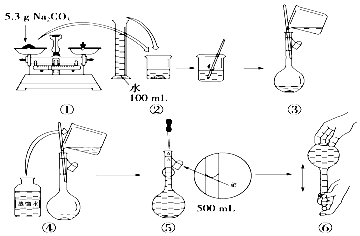
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
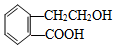 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.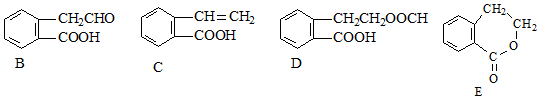
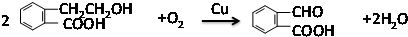 ,反应类型:氧化反应
,反应类型:氧化反应 ,反应类型:酯化反应
,反应类型:酯化反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
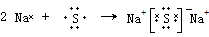 .
. .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性 B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com