
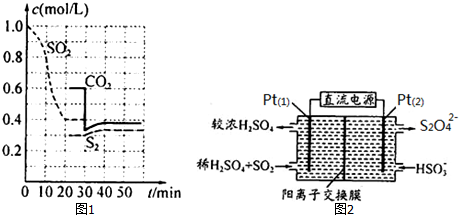
分析 (1)①可逆反应到达平衡时,各组分浓度保持不变;
②根据v=$\frac{△c}{△t}$计算v(SO2);
③30min时瞬间,CO2浓度降低,S2的浓度不变,而后CO2、S2的浓度均增大,应是减小CO2的浓度;
40min时的平衡常数和20min时相同,根据K=$\frac{c({S}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(S{O}_{2})}$计算平衡常数;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠;
②a.根据电荷守恒判断;
b.溶液可能是NaHSO3、Na2SO3混合溶液,根据物料守恒判断;
c.pH=6时溶液呈酸性,NaHSO3溶液中HSO3-的电离程度大于其水解程度;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度;
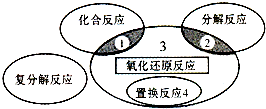
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸;
②根据电子转移守恒计算NO2的物质的量.
解答 解:(1)①从图中可看出20min时各组分浓度不变,此时反应达到平衡,故答案为:20;
②0~20min时,SO2浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,故v(SO2)=$\frac{0.6mol/L}{20min}$=0.03mol/(L•min),
故答案为:0.03mol/(L•min);
③30min时瞬间,CO2浓度降低,S2的浓度不变,而后CO2、S2的浓度均增大,应是减小CO2的浓度;
40min时的平衡常数和20min时相同,20min时,SO2(g)=0.4mol/L,S2(g)=0.3mol/L,CO2(g)=0.6mol/L,则平衡常数K=$\frac{c({S}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(S{O}_{2})}$=$\frac{0.3×0.{6}^{2}}{0.{4}^{2}}$=0.675,
故答案为:减小CO2的浓度;0.675;
(2)①Na2SO3溶液吸收SO2的离子方程式为SO32-+SO2+H2O=2HSO3-,
故答案为:SO32-+SO2+H2O=2HSO3-;
②a.根据电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),故a正确;
b.当溶质为NaHSO3时,溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),若还存在Na2SO3,则c(Na+)>c(SO32-)+c(HSO3-)+c(H2SO3),故b错误;
c.pH=6时溶液呈酸性,NaHSO3溶液中HSO3-的电离程度大于其水解程度,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-),故c错误;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于溶液的pH=6,水电离出c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L=l×l0-8 mol/L,故d正确,
故答案为:ad;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸,电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,
故答案为:SO2-2e-+2H2O=SO42-+4 H+;
②NO2转化为N2,根据电子转移守恒可知处理NO2的物质的量为$\frac{6mol}{4}$=1.5mol,
故答案为:1.5.
点评 本题考查反应速率计算、化学平衡计算与影响因素、离子浓度比较、电极反应式书写、电解池有关计算等,需要学生具备扎实的基础,侧重考查学生对知识的迁移应用,难度中等.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | D. | Fe+CuSO4═Cu+FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-13mol/L的溶液中:NO3-、S2O32-、K+、Na+ | |
| B. | 酸性高锰酸钾溶液中:Na+、C2O42-、CH3COO -、NH4+ | |
| C. | 澄清石灰水中:HCO3-、Ba2+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 用量筒、试管、胶头滴管、玻璃棒、蒸馏水和 pH试纸,可鉴别pH 相等的硫酸和醋酸 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯锌和稀硫酸反应 | B. | 用含铜等的粗锌和稀硫酸反应 | ||
| C. | 用纯锌和浓硫酸反应 | D. | 用含铜等的粗锌和稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 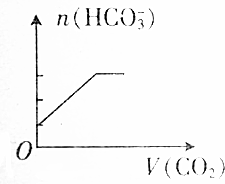 | B. | 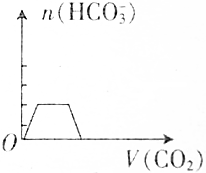 | ||
| C. | 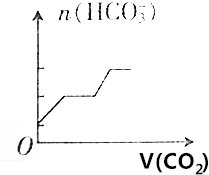 | D. | 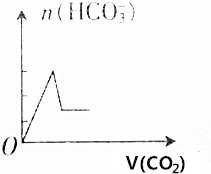 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com