
分析 只有碳元素一种元素组成的是单质;
能与碱反应生成盐和水的是酸性氧化物;
由金属离子与酸根离子构成的是盐;
水溶液中电离出的阳离子全部是氢离子的化合物为酸;
一般含碳元素的化合物为有机物,但不包括一氧化碳、二氧化碳与碳酸盐等.
解答 解:碳元素组成的物质很多,有单质和化合物,在下列物质中:
①石墨是一种元素组成的为单质;
②一氧化碳是氧化物,不与碱反应,属于不成盐氧化物;
③干冰是二氧化碳,和碱反应生成盐和水,属于酸性氧化物;
④碳酸水溶液中电离出的阳离子全部是氢离子,属于酸;
⑤碳酸钙是钙离子和碳酸根离子构成的化合物属于盐;
⑥乙醇是烃的衍生物,属于有机物;
所以属于单质的是 ①;属于酸性氧化物的是 ③;属于盐的是⑤; 属于酸的是④;属于有机物的是 ⑥.
故答案为:①;③;⑤;④;⑥.
点评 本题考查物质分类方法,物质组成的判断,注意单质和化合物的区别,明确化合物的不同类别,题目较简单.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:解答题
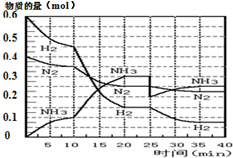 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③ | C. | ①②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
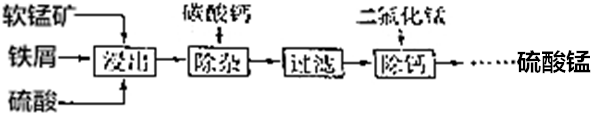
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v1、v2、K1、K2同时增大 | B. | v1、v2、K1、K2同时减小 | ||
| C. | v1、v2增大,K1增大,K2减小 | D. | v2减小,v1增大,K1增大,K2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一个该气体分子的质量为M/NA | |
| B. | 一个该气体分子的体积为Vm/NA | |
| C. | 气体摩尔体积的大小取决于气体分子本身的大小 | |
| D. | 上述说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com