
【题目】(1)3.01×1024个OH﹣的物质的量为____,质量为___,这些OH﹣与标准状况下__L NH3的物质的量相等,如果这些OH﹣来自2L的Ba(OH)2溶液,则该Ba(OH)2的物质的量浓度为__.
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的质量之比为___,所含电子数之比为__,相同质量的氨气和硫化氢气体的分子数之比为______密度之比为______.
(3)标况下8.96L 的CH4和CO混合气体,其质量为7.60g,则平均摩尔质量为____________,CH4和CO物质的量之比为________________。
(4)已知100mLAl2(SO4)3溶液中Al3+ 浓度为0.6mol/L,则SO42-的浓度为______________,Al2(SO4)3的物质的量为_____________(不考虑Al3+ 水解)
【答案】 5mol 85g 112 1.25mol/L 1:2 5:9 2:1 1:2 19g/mol 3:1 0.9mol/L 0.03mol
【解析】试题分析:(1)根据![]() 计算OH﹣的物质的量和质量;根据
计算OH﹣的物质的量和质量;根据![]() 计算NH3的体积;根据
计算NH3的体积;根据![]() 计算Ba(OH)2的物质的量浓度;(2)根据阿伏加德罗定律,同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等;根据阿伏加德罗定律的推论分析相同质量的氨气和硫化氢气体的分子数之比、密度之比;(3)标况下8.96L 的CH4和CO混合气体的总物质的量
计算Ba(OH)2的物质的量浓度;(2)根据阿伏加德罗定律,同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等;根据阿伏加德罗定律的推论分析相同质量的氨气和硫化氢气体的分子数之比、密度之比;(3)标况下8.96L 的CH4和CO混合气体的总物质的量![]() ,其质量为7.60g,根据
,其质量为7.60g,根据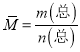 计算平均摩尔质量;(4)根据Al2(SO4)3=2Al3++3SO42-计算SO42-的浓度;根据n=cv计算Al2(SO4)3的物质的量。
计算平均摩尔质量;(4)根据Al2(SO4)3=2Al3++3SO42-计算SO42-的浓度;根据n=cv计算Al2(SO4)3的物质的量。
解析:(1)根据![]() ,3.01×1024个OH﹣的物质的量
,3.01×1024个OH﹣的物质的量![]() 5mol,质量m=5mol×17g/mol=85g,5mol NH3在标准状况下的体积是5mol×22.4L/mol=112L。如果5molOH﹣来自Ba(OH)2,则Ba(OH)2的物质的量是2.5mol,根据
5mol,质量m=5mol×17g/mol=85g,5mol NH3在标准状况下的体积是5mol×22.4L/mol=112L。如果5molOH﹣来自Ba(OH)2,则Ba(OH)2的物质的量是2.5mol,根据![]() ,该Ba(OH)2的物质的量浓度为
,该Ba(OH)2的物质的量浓度为![]() =1.25mol/L。
=1.25mol/L。
(2)根据阿伏加德罗定律,同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量相等,设NH3、H2S 的物质的量都是1mol,则NH3、H2S的质量分别是17g、34g,所以质量之比为17:34=1:2,1个NH3分子含10个电子,1个H2S防止含18个电子,所含电子数之比为10:18=5:9;根据阿伏伽德罗定律的推论,相同质量的气体,分子数比等于摩尔质量的反比,所以相同质量的氨气和硫化氢气体分子数之比为34:17=2:1;同温同压,气体的密度比等于摩尔质量的比,密度之比为17:34=1:2。
(3)标况下8.96L 的CH4和CO混合气体的物质的量是![]() ,其质量为7.60g,根据
,其质量为7.60g,根据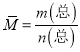 ,平均摩尔质量为
,平均摩尔质量为![]() 19g/mol,设CH4和CO物质的量分别是xmol、ymol,则
19g/mol,设CH4和CO物质的量分别是xmol、ymol,则![]() ,解得
,解得![]() ,CH4和CO物质的量之比为3:1。
,CH4和CO物质的量之比为3:1。
(4)100mLAl2(SO4)3溶液中Al3+ 浓度为0.6mol/L,Al3+的物质的量是0.1L×0.6mo/L=0.06mol, 根据Al2(SO4)3=2 Al3++3SO42-,则SO42-的浓度为0.9mol/L,Al2(SO4)3的物质的量为0.03mol。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】下列是几种原子的基态电子排布,电负性最大的原子是( )
A. 1s22s22p4 B. 1s22s22p63s23p3
C. 1s22s22p63s23p2 D. 1s22s22p63s23p64s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与化学密切相关。下列物质与材料对应关系不正确的是
A. 晶体硅——光导纤维 B. 氧化铝——耐火材料
C. 铁碳合金——碳素钢 D. 硅酸盐——普通玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是( )
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O![]() >I2
>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3 + 3Na2O2 ![]() 2Na2FeO4 + Na2O,下列说法正确的是( )
2Na2FeO4 + Na2O,下列说法正确的是( )
A.反应中Fe2O3是还原剂
B.Fe2O3可以通过铁丝在氧气中燃烧制得
C.3molNa2O2反应,有3mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是( )
A. 干冰可用作致冷剂 B. 在铁制容器表面刷铝粉可防止生锈
C. 氢氧化钠可用作医用胃酸中和剂 D. 过氧化钠可用作供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表及元素周期律,下列推断中正确的是
A. 同一周期元素的原子,半径越小越容易失去电子
B. ⅠA族元素的金属性比ⅡA族元素的金属性强
C. 向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱
D. 主族元素的最高正化合价等于该元素原子的核外电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
2C(石墨,s)+O2(g)===2CO(g) ΔH=-222 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
则CO还原H2O(g)的热化学方程式为__________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池工作时的负极电极反应式:______________________________________________________________。
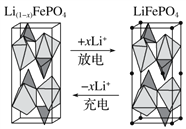
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应式:___________。
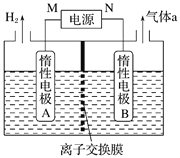
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如下图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的_______(填“正”或“负”)极,B极区电解液为_______(填化学式)溶液,该离子交换膜是_______(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com