


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
 可由有机化工原料R和其他有机试剂通过加成、水解、氧化、缩聚反应得到,则R是( )
可由有机化工原料R和其他有机试剂通过加成、水解、氧化、缩聚反应得到,则R是( )| A、1-丁烯 | B、2-丁烯 |
| C、1,3-丁二烯 | D、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) |
| B、c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-) |
| C、HCO3- 的电离程度大于HCO3-的水解程度 |
| D、其电离方程式为:NaHCO3?Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
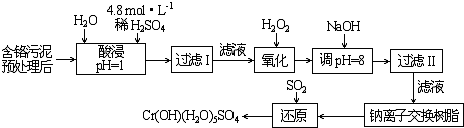
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银器表面在空气中因电化腐蚀渐渐变暗 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D、可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com