

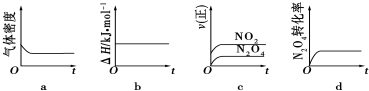
| A. | 依据图甲可判断正反应为放热反应 | |
| B. | 在图乙中,虚线可表示使用了催化剂 | |
| C. | 若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动 | |
| D. | 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
分析 A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应;
B、使用催化剂化学反应速率增大,缩短反应达到平衡的时间,化学平衡不移动;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应.
解答 解:A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应,正向是放热反应,可以判断反应热量变化,故A正确;
B、使用催化剂化学反应速率增大,缩短反应达到平衡的时间,化学平衡不移动,所以虚线可表示使用了催化剂,故B正确;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率,图象符合反应速率的变化,故C正确;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应△H<0,故D错误;
故选D.
点评 本题考查化学平衡的建立和影响因素的分析判断,图象分析判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是二氧化硅 | |
| B. | SiO2不与水反应,所以二氧化硅不是酸性氧化物 | |
| C. | 装有烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱与二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 | |
| D. | 晶体硅是良好的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加入BaCl2,产生白色浑浊说明该溶液中一定有SO42- | |
| B. | 向淀粉碘化钾溶液中加氯水,溶液变为蓝色说明氯气的氧化性强于碘单质 | |
| C. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定有CO32- | |
| D. | 某溶液滴加稀盐酸无明显现象,再加硝酸银产生白色沉淀,说明溶液中含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁易被腐蚀,纯铁不易被腐蚀 | |
| B. | 常温下可用铁制容器来运输浓硫酸 | |
| C. | Fe2+的检验:取少量样品溶液,加入适量氯水,再滴2滴KSCN溶液,振荡观察 | |
| D. | 工业上常用稀盐酸或稀硫酸除铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大氧气浓度,平衡正向移动,平衡常数不变 | |
| B. | 降低温度,正反应速率比逆反应速率减小的程度小 | |
| C. | 平衡时SO2气体的转化率为50% | |
| D. | 该条件下反应放出0.5QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中:c(H+)+c(Na+)═c(OH-)+c(CO32-)+c(HCO3-) | |
| B. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+) | |
| C. | 0.1mol/L的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)═c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是硅 | B. | 水晶项链的主要成分是硅酸盐 | ||
| C. | 晶体硅能用来制造太阳能电池 | D. | 二氧化硅是一种半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 将氯气通入到水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-═CaCO3↓+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2═Fe3++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com