
| A. | 常温下能够使pH试纸显红色的溶液 | B. | 常温下能够使甲基橙显黄色的溶液 | ||
| C. | [OH-]>[H+]的溶液 | D. | 加入MgCl2生成白色沉淀的溶液 |
分析 只要溶液中存在[OH-]>[H+],则该溶液一定呈碱性,如果溶液中存在[OH-]=[H+],则溶液一定呈中性,如果[OH-]<[H+],则溶液一定呈酸性,根据溶液中[OH-]、[H+]相对大小确定溶液酸碱性,据此分析解答.
解答 解:A.常温下能够使pH试纸显红色的溶液呈酸性,故A错误;
B.常温下甲基橙的变色范围是3.1-4.4,则能使甲基橙显黄色的溶液可能呈酸性、中性或碱性,故B错误;
C.溶液中存在[OH-]>[H+],则该溶液一定呈碱性,故C正确;
D.能和加入MgCl2生成白色沉淀的溶液可能呈酸性或碱性,溶液硝酸银溶液呈酸性、氢氧化钠溶液呈碱性,故D错误;
故选C.
点评 本题考查溶液酸碱性判断,为高频考点,温度未知时不能根据溶液pH判断溶液酸碱性,不能根据酸碱指示剂判断溶液酸碱性,只有根据[OH-]、[H+]相对大小才能判断溶液酸碱性,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 0.1molAgCl和0.1molAgl混合后加入1 L水中,所得溶液中c(Cl-)>c(I-) | |
| D. | 25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
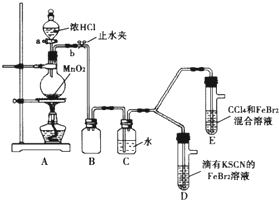 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径;r(Z)>r(W)>r(Q) | |
| B. | 气态氢化物的热稳定性:W>Q>Z | |
| C. | X与Z形成的化合物呈碱性的原因:Z2-+2H2O?H2Z+2OH- | |
| D. | Y与Z的二元化合物可以在溶液中通过复分解反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
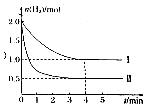 工业上可用CO2与H2反应生成甲醇,在T℃下,将1mol CO2 和2mol H2 充入5L恒容密闭容器中发生反应;CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得H2的物质的量随时间的变化情况如图中曲线Ⅰ所示.
工业上可用CO2与H2反应生成甲醇,在T℃下,将1mol CO2 和2mol H2 充入5L恒容密闭容器中发生反应;CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得H2的物质的量随时间的变化情况如图中曲线Ⅰ所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、OH-、NO3-、HCO3- | ||
| C. | OH-、Ba2+、Na+、AlO2- | D. | Fe3+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 化学解释 |
| A | 古琴在制作时需要对木材进行火烧处理 | 表面生成的碳在常温下化学性质稳定 |
| B | 唐代的“宝应象棋”以金铜合金造型,内灌铅芯 | 合金的熔沸点一般低于成分金属,利于造型 |
| C | 古时写字用黄纸,书写时“有误字,以雌黄灭之” | 雌黄为橙黄色矿物,可作颜料或者褪色剂 |
| D | 宣纸为古典书画用纸,“始于唐代,产于径县” | 造纸过程只有物理变化,没发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com