
下列实验装置设计正确,且能达到目的的是( )
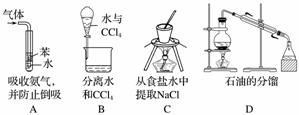
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
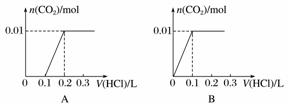
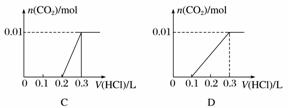
查看答案和解析>>
科目:高中化学 来源: 题型:
下列为各组指定的元素原子的价电子排布式,不能形成AB2型化合物的是( )
A.2s22p2和2s22p4 B.3s23p4和2s22p4
C.3s2和2s22p5 D.3s1和3s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
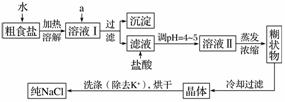
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO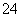 ,选出a所代表的试剂,按滴加顺序依次为____________(只填化学式)。
,选出a所代表的试剂,按滴加顺序依次为____________(只填化学式)。
(2)用于沉淀的试剂需过量,判断除去SO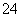 的试剂过量的方法是________________________________________________________________________。
的试剂过量的方法是________________________________________________________________________。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
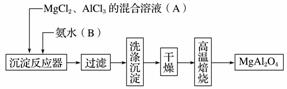
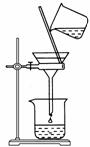
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)如右图所示,过滤操作中的一处错误是________________。
(3)判断流程中沉淀是否洗净所用的试剂是__________________。高温焙烧时,用于盛放固体的仪器名称是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种分离乙醇、乙酸的方案中最佳的一组是( )
乙醇、乙酸的混合液(含少量水)

| a | b | c | d | |
| A | Na2CO3饱和溶液 | 乙酸钠 | 硫酸 | 蒸馏 |
| B | Na2CO3固体 | 乙酸钠 | 盐酸 | 过滤 |
| C | CaO固体 | 乙酸钙 | 盐酸 | 过滤 |
| D | CaO固体 | 乙酸钙 | 硫酸 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
结合事实判断CO和N2相对更活泼的是____________,试用下表中的键能数据解释其相对更活泼的原因:____________________。
| CO | C—O | C===O | C≡O |
| 键能(kJ·mol-1) | 357.7 | 798.9 | 1 071.9 |
| N2 | N—N | N===N | N≡N |
| 键能(kJ·mol-1) | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A.氢键;分子间作用力;极性键
B.氢键;氢键;非极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请你回答下列问题:
(1)请按要求任意写一个相应物质:(填化学式)
含有非极性键的离子化合物________,既含有非极性键又含极性键的非极性分子________,既含有非极性键又含极性键的极性分子________,全部由非金属元素组成的离子化合物________,由金属元素和非金属元素组成的共价化合物________。
(2)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ的分子结构如图1所示。

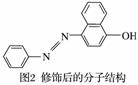
苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示的结构,则其在水中的溶解度会________(填“增大”或“减小”),原因是______________。
(3)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为________________,由Cl-所形成的化学键类型是________。
(4)右图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是______;表示ⅣA族元素氢化物沸点的曲线是______;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是________________________________________________________________________;
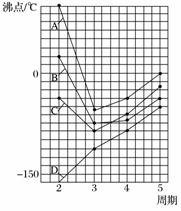
A、B、C曲线中第2周期元素的氢化物的沸点显著高于第3周期元素的氢化物的沸点,其原因是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com