
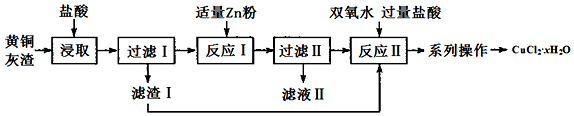
分析 黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)中加入稀盐酸,稀盐酸可Zn、CuO、ZnO、FeO、Fe2O3反应生成Zn2+、Cu2+、Fe2+、H+,铜将其中的少量的Fe3+反应为Fe2+,滤渣Ⅰ为铜,滤液Ⅰ主要含有Zn2+、Cu2+、Fe2+、H+,加入适量锌粉,锌粉可与Cu2+、Fe3+、H+反应生成铜,滤液Ⅱ主要的金属离子就是Zn2+、Fe2+,过滤得到铜,向铜中加入双氧水和盐酸发生反应Cu+H2O2+2HCl=CuCl2+2 H2O,得到氯化铜的溶液,对溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得产品,据此分析解答.
解答 解:(1)锌粉过量会使Fe2+还原为铁单质,产品不纯,含有杂质;
故答案为:加入过量的Zn会使产品中含有杂质;
(2)向Zn2+、Cu2+、Fe2+、H+,加入适量锌粉,锌粉与氢离子、铜离子反应生成锌离子、氢气、铜单质,滤液Ⅱ主要的金属离子就是Zn2+、Fe2+;
故答案为:Zn2+、Fe2+;
(3)反应Ⅱ为铜与双氧水和盐酸反应,化学方程式为:Cu+H2O2+2HCl=CuCl2+2 H2O;
故答案为:Cu+H2O2+2HCl=CuCl2+2 H2O;
(4)由氯化铜的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得产品;
故答案为:洗涤、干燥;
(5)在空气中直接加热CuCl2•xH2O晶体得不到纯的无水CuCl2,原因是部分铜离子水解生成氢氧化铜:2CuCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$ Cu(OH)2•CuCl2+2HCl+(2x-2)H2O;
故答案为:2CuCl2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$ Cu(OH)2•CuCl2+2HCl+(2x-2)H2O;
(6)①用含Fe3+的溶液作指示剂,用KSCN标准溶液滴定剩余的AgNO3.使剩余的Ag+以AgSCN白色沉淀的形式析出,银离子沉淀完全时溶液变为血红色,且30s不褪色;
故答案为:溶液变为血红色,且30s不褪色;
②滴定过程用去0.2000mol•L-1的KSCN标准溶液20.00mL,则剩余AgNO3为0.2000×20×10-3mol=0.4×10-2mol,由CuCl2~2AgNO3,n(CuCl2)=$\frac{1}{2}$×(4.400×10-2mol-0.4×10-2mol)=2×10-2mol,m(CuCl2)=2×10-2mol×135g/mol=2.7g,则n(H2O)=$\frac{3.420g-2.7g}{18g/mol}$=0.04mol,n(CuCl2):n(H2O)=1:2,故x=2;
故答案为:2.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、物质含量测定、实验方案设计、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
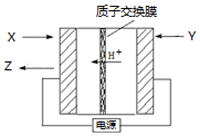 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | Y参与的电极反应为H2+2e-=2H+ | |
| B. | 反应过程中左边区域溶液pH逐渐升高 | |
| C. | 图中所示物质中,X为H2,Y为N2 | |
| D. | 当有3g H+通过质子交换膜时,Z的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{500℃、30M}$2NH3(g)?△H=-38.6 kJ•mol-1 | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
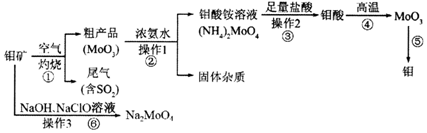
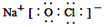 ;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O
;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛装碱性试剂的试剂瓶应该使用橡皮塞 | |
| B. | 分离酒精和水可以采用分液法 | |
| C. | 蒸发结晶时应该将水分全部蒸干 | |
| D. | 在托盘天水左右托盘各放质量大小相同的纸,在左边纸上放氢氧化钠称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 明矾 | 食盐 | 石墨 | 醋酸 |
| D | KOH | CuSO4 | Na2SO4 | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度一定是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,pH=6的醋酸与醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1 NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)═2c(H+)+c(CH3COOH) | |
| D. | 常温下pH=6的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com