
【题目】在NaCl和Na2SO4的混合液中,当Cl﹣的物质的量浓度是Na+的物质的量浓度的0.6倍时,下列叙述正确的是( )
A.溶液中可能含有0.5mol Na2SO4和1.5molNaCl
B.SO42﹣离子和Cl﹣离子的物质的量之和等于Na+的物质的量
C.SO42﹣所带的电荷数是Na+所带的电荷数的 ![]() 倍
倍
D.Na2SO4和NaCl物质的量浓度之比为1:3
【答案】A,D
【解析】A、0.5mol Na2SO4和1.5molNaCl含有Na+、Cl﹣的物质的量分别为:2.5mo、1.5mol,Cl﹣的物质的量是Na+的物质的量的0.6倍,所以Cl﹣的物质的量浓度是Na+的物质的量浓度的0.6倍,故A符合题意;
B、由电荷守恒得:2n(SO42﹣)+n(Cl﹣)=n(Na+);Cl﹣的物质的量浓度是Na+的物质的量浓度的0.6倍,即Cl﹣的物质的量是Na+的物质的量的0.6倍,2n(SO42﹣)= ![]() n(Na+);n(SO42﹣)=
n(Na+);n(SO42﹣)= ![]() n(Na+),SO42﹣离子和Cl﹣离子的物质的量之和为Na+的物质的量的0.8倍,故B不符合题意;
n(Na+),SO42﹣离子和Cl﹣离子的物质的量之和为Na+的物质的量的0.8倍,故B不符合题意;
C、由电荷守恒得:所以2Q(SO42﹣)+Q(Cl﹣)=Q(Na+),由于Cl﹣的物质的量浓度是Na+的物质的量浓度的0.6倍,所以Q(Cl﹣)=0.6Q(Na+),使得:Q(SO42﹣)=0.2Q(Na+),故C不符合题意;
D、由电荷守恒得:2c(SO42﹣)+c(Cl﹣)=c(Na+),由于Cl﹣的物质的量浓度是Na+的物质的量浓度的0.6倍,所以c(Cl﹣)=0.6c(Na+),则c(SO42﹣)=0.2c(Na+),所以Na2SO4和NaCl的物质的量之比为:1:3,故D符合题意.
故答案为:AD.
根据Cl﹣的物质的量浓度是Na+的物质的量浓度的0.6倍,计算硫酸根离子的物质的量,结合同一溶液中浓度值比等于物质的量之比进行分析即可.


科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是_______。
A.蔗糖
B.硫酸钾
C.高锰酸钾
D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为molL-1。
(3)配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、、、。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凡有一个手性碳原子的物质具有光学活性,如图物质 有光学活性,发生下列反应后生成的有机物 仍有光学活性的是( )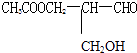
A.与乙酸发生酯化反应
B.与NaOH水溶液共热
C.与银氨溶液作用
D.在催化剂存在下与H2作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示的反应关系:A是中学化学中常见的无机物,A、B、C中含有同一种元素R,不含R的产物已略去. A ![]() B+C
B+C
(1)若A与NaOH反应,既可生成B,也可只生成C,还可以生成C+B.写出符合上述反应关系的A的两种不同物质的分子式:
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A的分子式可能是(只写一种):;R在A、B、C中的化合价必须满足的条件是:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对 空气与地面进行消毒.
(1)配制 220mL0.05mol/L 的过氧乙酸溶液,需使用的仪器有:烧杯、量筒、玻璃棒及、、
(2)配制过程中,可能引起浓度偏高的操作有
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.转移溶液时,不慎有少量溶液洒在容量瓶外
C.定容时,俯视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线
(3)下列叙述正确的是 (填字母)
A.可用过滤的方法将过氧乙酸溶液中混有的 NaCl 除掉
B.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
C.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(4)如果生产过氧乙酸的原料 CH3COONa 中混有了 SO42﹣ , 要想除掉 SO42﹣请选择下列试剂按照加入先后顺序填空(试剂不必选完,填序号即可)
①盐酸 ②醋酸钡溶液 ③氯化钡溶液 ④醋酸 ⑤碳酸钠溶液 ⑥碳酸氢钠溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是
A.移液时,不慎将液体流到瓶外
B.容量瓶盛过NaCl溶液,使用前未洗涤
C.容量瓶中原有少量的蒸馏水
D.定容时读数仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( ) 
A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.反应物的总能量高于生成物的总能量
D.H2O2分解的热化学方程式:H2O2═H2O+ ![]() O2△H<0
O2△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com