
| �Ʊ����� | �������� |
| �ɷ� | Fe2O3��KNO3��KOH��ϼ��ȹ��������Ϻ�ɫ������غ�KNO2�Ȳ��� |
| ʪ�� | ǿ���Խ����У�Fe��NO3��3��KClO��Ӧ�����Ϻ�ɫ���������Һ |
| ��ⷨ | ���ŨNaOH��Һ�Ʊ�Na2FeO4 |
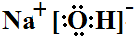 ��
��
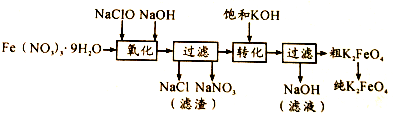
���� ��1��������ΪKNO3������ԭ����KNO2����ԭ��ΪFe2O3������������K2FeO4�����ݵ���ת���غ���㣻
��2�������������ڼ��������±�����������������Na2FeO4�����˳�ȥ����NaCl�������ƣ����뱥��KOH��Һ��Na2FeO4ת��Ϊ�ܽ�ȸ�С��K2FeO4����Ӧ����ʽΪNa2FeO4+2KOH=K2FeO4+2NaOH����ȴ�ᾧ�����ˣ�ϴȥ������ؾ�������KOH���������ʣ��õ�����Ʒ������أ�
�ٷ�Ӧ����ʽΪ��2Fe��NO3��3+3NaClO+10NaOH=2Na2FeO4+6NaNO3+3NaCl+5H2O��
��Na2FeO4ת��Ϊ�ܽ�ȸ�С��K2FeO4��������
���ɲ������̿�֪�����ؽᾧ�����ᴿ���ܽ����˳�ȥ��������������������������������أ����Ҵ�ϴ�ӣ�ϴȥ�������ӻ������������ܽ�µ���ʧ��
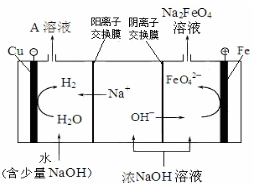
��FeO42-����ǿ�����ԣ���������Cl-��
��3��������Feʧȥʧȥ���ӣ���������������FeO42-��
�����ҵõ�A��ҺΪNaOH��Һ������ѭ�����ã�
��4��c��Cu2+��=$\frac{Ksp[Cu��OH��_{2}]}{{c}^{2}��O{H}^{-}��}$��c��Fe3+��=$\frac{Ksp[Fe��OH��_{3}]}{{c}^{3}��O{H}^{-}��}$���������㣮
��� �⣺��1��������ΪKNO3������ԭ����KNO2����ԭ��ΪFe2O3������������K2FeO4�����ݵ���ת���غ㣬��5-3����n��KNO3��=2��n��Fe2O3������6-3�����ɵã�n��KNO3����n��Fe2O3��=3��1��
�ʴ�Ϊ��3��1��
��2�������������ڼ��������±�����������������Na2FeO4�����˳�ȥ����NaCl�������ƣ����뱥��KOH��Һ��Na2FeO4ת��Ϊ�ܽ�ȸ�С��K2FeO4����Ӧ����ʽΪNa2FeO4+2KOH=K2FeO4+2NaOH����ȴ�ᾧ�����ˣ�ϴȥ������ؾ�������KOH���������ʣ��õ�����Ʒ������أ�
�ٷ�Ӧ����ʽΪ��2Fe��NO3��3+3NaClO+10NaOH=2Na2FeO4+6NaNO3+3NaCl+5H2O����Ӧ���ӷ���ʽΪ��3ClO-+2Fe3++10OH-�T2FeO42-+3Cl-+5H2O��
�ʴ�Ϊ��3ClO-+2Fe3++10OH-�T2FeO42-+3Cl-+5H2O��
�ڸ��¶��¸�����ص��ܽ�ȱȸ������Ƶ��ܽ��С�����뱥��KOH��Һ��������K+��Ũ�ȣ���С������ص��ܽ⣬�ٽ�������ؾ���������
�ʴ�Ϊ�����¶��¸�����ص��ܽ�ȱȸ������Ƶ��ܽ��С��
���ɲ������̿�֪�����ؽᾧ�����ᴿ���ܽ����˳�ȥ��������������������������������أ����Ҵ�ϴ�ӣ�ϴȥ�������ӻ������������ܽ�µ���ʧ��
�ʴ�Ϊ���ؽᾧ�����ˣ��Ҵ���
��FeO42-����ǿ�����ԣ�Cl-��FeO42-���������IJ�Ʒʹ���ʽ��ͣ�
�ʴ�Ϊ��Cl-��FeO42-���������IJ�Ʒʹ���ʽ��ͣ�
��3��������Feʧȥʧȥ���ӣ���������������FeO42-�������缫��ӦʽΪ��Fe-6e-+8OH-=FeO42-+4H2O��
�����ҵõ�A��ҺΪNaOH��Һ������ѭ�����ã�NaOH�ĵ���ʽΪ��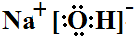 ��
��
�ʴ�Ϊ��Fe-6e-+8OH-=FeO42-+4H2O��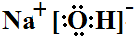 ��
��
��4����Һ��c��OH-��=10-4 mol/L��c��Cu2+��=$\frac{Ksp[Cu��OH��_{2}]}{{c}^{2}��O{H}^{-}��}$��c��Fe3+��=$\frac{Ksp[Fe��OH��_{3}]}{{c}^{3}��O{H}^{-}��}$���ɵ���Һ��c��Cu2+����c��Fe3+��=$\frac{2.2��1{0}^{-20}}{��1{0}^{-4}��^{2}}$��$\frac{4��1{0}^{-38}}{��1{0}^{-4}��^{3}}$=5.5��1013��1��
�ʴ�Ϊ��5.5��1013��1��
���� ���⿼��������ԭ��Ӧ���������������̡����ԭ�����ܶȻ��йؼ���ȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ�����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ը��������Һ�����������ϩ | |
| B�� | �÷�Һ©��������ȩ��ˮ | |
| C�� | �ñ�����ˮ�����ۻ����ȡ�屽 | |
| D�� | ����ɫʯ����Һ���鱽�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������Ȼ�л��߷��ӻ����û�е����ʾ�û������ | |
| B�� | HCHO��Һ��NH4��2SO4��Һ����ʹ�����ʱ��� | |
| C�� | ijЩ�����ʸ�Ũ�������û��� | |
| D�� | ���Բ��ö���������������ķ������롢�ᴿ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
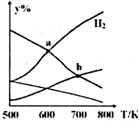 ��CO2��H2Ϊԭ����ȡ�Ҵ��ķ�ӦΪ��2CO2��g��+6H2��g���TCH3CH2OH��g��+3H2O��g����H��0��ijѹǿ�µ��ܱ������У���CO2��H2�����ʵ�����Ϊ1��3Ͷ�ϣ���ͬ�¶��£��ﵽƽ���ƽ����ϵ�и����ʵ����ʵ���������y%�����¶ȱ仯��ͼ��ʾ������˵����ȷ���ǣ�������
��CO2��H2Ϊԭ����ȡ�Ҵ��ķ�ӦΪ��2CO2��g��+6H2��g���TCH3CH2OH��g��+3H2O��g����H��0��ijѹǿ�µ��ܱ������У���CO2��H2�����ʵ�����Ϊ1��3Ͷ�ϣ���ͬ�¶��£��ﵽƽ���ƽ����ϵ�и����ʵ����ʵ���������y%�����¶ȱ仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | a���ƽ�ⳣ��С��b�� | B�� | b�㣺v����CO2��=v����H2O�� | ||
| C�� | a�㣺n��H2��=n��H2O�� | D�� | �¶Ȳ��䣬�������H2��D��CO2������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | �״� | ������ | ��������� |
| �е�/�� | 64.7 | 249 | 199.6 |
| ��Է������� | 32 | 122 | 136 |

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
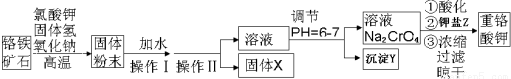
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH3+Cl2$\stackrel{����}{��}$CH3CH2Cl+HCl | |
| B�� | CH2=CH2+HBr��CH3CH2Br | |
| C�� |  | |
| D�� | CH3COOH+CH3CH2OH$��_{��}^{Ũ����}$CH3COOCH2CH3+H20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
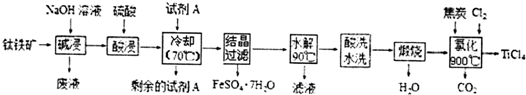
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO | B�� | N2O3 | C�� | NO2 | D�� | N2O4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com