
分析 (1)燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),1mol烃的耗氧量为(x+$\frac{y}{4}$)mol;
(2)质量相同时,C元素质量分数越大生成二氧化碳越多,H元素质量分数越大生成水越多;
(3)质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多;
(4)120℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),完全燃烧前后气体体积没有变化,则反应前后气体总化学计量数不变.
解答 解:(1)1mol烃CxHy的耗氧量为(x+$\frac{y}{4}$)mol,则等物质的量的CH4、C2H4、C3H4、C2H6、C3H6中消耗O2最多的是 C3H6,
故答案为:C3H6;
(2)质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,CH4、C2H4、C3H4、C2H6、C3H6的H%大小为:CH4>C2H6>C3H6=C2H4>C3H4,故完全燃烧时消耗O2的量最多的是CH4,
故答案为:CH4;
(3)烃的质量相等时,碳的质量分数越大,完全燃烧时生成的CO2越多,CH4、C2H4、C3H4、C2H6、C3H6的C%大小为:CH4<C2H6<C3H6=C2H4<C3H4故完全燃烧生成的CO2最多的是C3H4;
质量相同时,分子中H元素的质量分数越大,分子中C元素的CH4、C2H4、C3H4、C2H6、C3H6的H%大小为:CH4>C2H6>C3H6=C2H4>C3H4,完全燃烧时生成H2O越多,故生成水最多的是CH4,
故答案为:C3H4;CH4;
(4)120℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),完全燃烧前后气体体积没有变化,则1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,故y=4,即CH4、C2H4、C3H4完全燃烧后体积不变,
故答案为:CH4、C2H4、C3H4.
点评 本题考查烃燃烧有关规律,充分利用组成通式与对燃烧通式解答,侧重考查学生的分析计算能力,注意对规律的理解与掌握.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
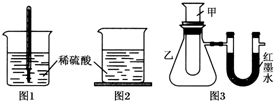
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化钙是一种强氧化剂 | |
| B. | 加热时,氢化钙能跟干燥氧气反应生成水 | |
| C. | 氢化钙(CaH2)是离子化合物,固体中含H-H键 | |
| D. | 可以取少量试样滴加几滴水,检验反应是否产生氢气来区别金属钙与氢化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
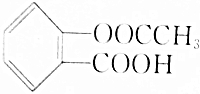 ]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、NO3- | B. | K+、Na+、Br-、SiO32- | ||
| C. | H+、Fe2+、SO42-、Cl2 | D. | K+、Ag+、NH3•H2O、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中溶质的物质的量相等 | B. | 溶液中的c(H+)相等 | ||
| C. | 与足量锌粉反应产生的H2量相等 | D. | 可以电离出来的n(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池负极发生氧化反应 | |
| B. | 一般相对活泼的金属材料做电池的负极 | |
| C. | 电子流向是从负极流向正极(外电路) | |
| D. | 阳离子移向负极(内电路) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com