
下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是
A.Na2O2、Al2(SO4)3、MgCl2、K2CO3 B.BaCl2、Na2SO4、(NH4)2SO4、KOH
C.AgNO3、NaCl、KCl、CuCl2 D.Fe2(SO4)3、K2CO3、KHSO4、NH4Cl
科目:高中化学 来源: 题型:
短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等。下列叙述正确的是
A.原子半径:C<B B.元素A、C的氧化物均为共价化合物
C.金属性:D>C D.元素B、C、D的最高价氧化物对应水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律表述正确的是
A.原子序数为15的元素的最高化合价为+3
B.第ⅦA族元素是同周期中非金属性最强的元素
C.Li、Na、K、Rb、Cs的得电子能力逐渐增强
D.原子序数为12的元素位于元素周期表的第三周期的ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
工业常用浓硫酸分解钛铁矿FeTiO3(含有FeO、Fe2O3杂质)方法来制备钛白(TiO2)工艺流程如下图所示。
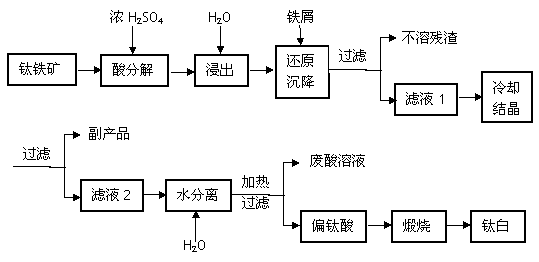
 金属钛具有密度小、比强度高、耐腐蚀(如酸或碱)、无毒等优点,已广泛应用于航天工业,并逐步进入了化工、船舶、汽车等领域,并显示了巨大的发展潜力。工业上冶炼常用还原法由钛白得到金属钛。主要的工艺流程如下图所示。
金属钛具有密度小、比强度高、耐腐蚀(如酸或碱)、无毒等优点,已广泛应用于航天工业,并逐步进入了化工、船舶、汽车等领域,并显示了巨大的发展潜力。工业上冶炼常用还原法由钛白得到金属钛。主要的工艺流程如下图所示。


回答下列问题:
(1)浓硫酸处理钛铁矿时生成两种硫酸盐且无气体放出,写出FeTiO3(Fe+2价)在浓硫酸中分解的反应方程式_____________________________________________________;
(2)加铁屑的目的是___________________________________(用离子方程式表示),滤液1冷却结晶得到副产品的俗称是______________________(写名称);
(3)滤液2稀释加热水解得到偏钛酸(H2TiO3)的方程式______________________________;
(4)冶炼金属钛时反应①通常在800~900℃的条件下进行,产物中还有一种可燃性无色气体,该反应的方程式为______________________________________________________。
(5) 冶炼金属钛时反应②也在800~900℃的条件下进行,反应中需要加入氩气的理由是___________________;反应后的产物中需要加入_____________才能达到分离的目的。
(6)已知25℃、100kPa时TiCl4为液态,实验测得该条件下12g镁反应能释放出266.1kJ 热量,反应②的热化学方程式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列各组离子在指定溶液中能大量共存的是
A. 饱和氯水中:Cl-、NO3-、Na+、SO32-
B. c(H+)=1.0×10-13mol/L溶液中:C6H5O-、K+、SO42-、Br-
C. Na2S溶液中:SO42-、 K+、Cl-、Cu2+
D. pH=12的溶液中:NO3-、I-、Na+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的叙述正确的是
A.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
B. 除去乙烷中少量的乙烯,可在光照条件下通入Cl2,再气液分离
C.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D.蛋白质、葡萄糖、油脂均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池装置如右图所示。下列有关叙述正确的是( )
A.Fe作正极,发生氧化反应
B.负极反应: 2H+ + 2e-= H2↑
C.工作一段时间后,NaCl溶液中c(Cl-)增大
D.工作一段时间后,两烧杯中溶液pH均不变

查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里需用480mL0.1mol/L的硫酸铜溶液,现选取500ml容量瓶进行配置,以下操作正确的是( )
A.称取7.68g硫酸铜,加入500ml水 B.称取12.0g胆矾配成500ml溶液
C.称取8g硫酸铜,加入500ml水 D.称取12.5g胆矾配成500ml溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生 成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
① 请结合上表数据,写出NO与活性炭反应的化学方程式 。
② 上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= ,
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)__________。
a.T1>T2 b.T1<T2 c.无法比较
(2)CO2在实验室常用氢氧化钠来吸收,现有8.96 L CO2(标态),若用200ml 3mol/LNaOH 溶液将其恰好完全吸收,反应的离子方程式为 ,
所得溶液中离子浓度由大到小的顺序为 。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。现将浓度为2×10—4mo1/L Na2CO3溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为 。
(4)若用如右图装置,以CO2和H2为原料制备甲醇,发生
反应为 ,则b电极的电
,则b电极的电
极反应式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com