
| A. | Na20和SiO2熔化 | B. | 冰和金刚石熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | 碘和干冰升华 |
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强增大 | B. | KO2的量保持不变 | C. | 平衡常数减小 | D. | 氧气浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 适宜条件下,SO2和O2可以完全转化为SO3 | |
| B. | 反应达到平衡后正逆反应的速率皆为零 | |
| C. | 若用18O2进行反应,达到平衡时二氧化硫中也会有18O | |
| D. | 工业合成SO3时,既要考虑反应速率也要考虑反应限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4LH20中共价键总数为2NA | |
| B. | 32gO3中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入1molN2和3 mol H2,充分反应后得2NA个NH3分子 | |
| D. | 1.8g的NH4+中含有电子的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
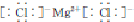 ,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.
,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能. (g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$
(g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$ (g)
(g) 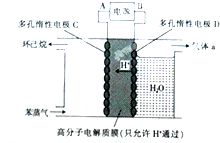
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,⑦CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,⑧CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr.
,⑦CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2+NaBr+H2O,⑧CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠有还原性,可用作脱氧剂 | B. | FeCl3有氧化性,可用于制印刷电路 | ||
| C. | 铝有还原性,可冶炼某些金属 | D. | 浓硫酸有吸水性,可用于干燥氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com