
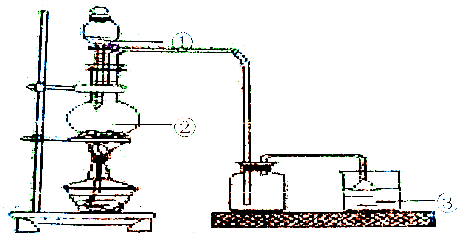
分析 (1)实验室用浓盐酸和二氧化锰加热制取氯气;
(2)a.分液漏斗中盛放浓盐酸;烧瓶中盛放二氧化锰固体;氯气有毒,不能直接排空,氯气能和碱溶液反应生成盐,所以可以用碱液吸收氯气;
b.为防止产生倒吸现象,尾气处理中用倒置漏斗.
解答 解:(1)实验室用浓盐酸和二氧化锰加热制取氯气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)a.分液漏斗中盛放浓盐酸,所以①中盛放的是浓盐酸;烧瓶中盛放二氧化锰固体,所以②中盛放的是MnO2;氯气有毒,不能直接排空,氯气能和碱溶液反应生成盐,所以可以用碱液吸收氯气,所以③中药品可以是NaOH溶液,
故答案为:浓盐酸;MnO2;NaOH溶液;
b.氯气极易和NaOH溶液反应而导致压强急剧减小,为防止产生倒吸现象,尾气处理中用倒置漏斗,
所以倒置漏斗的作用是防倒吸,故答案为:防倒吸.
点评 本题考查实验室制取氯气方法,为高频考点,明确实验原理是解本题关键,知道倒置漏斗作用,为易错点.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:解答题
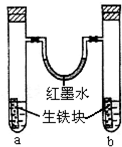 如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题:
如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
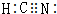 ,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.
,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其中的化学键属于共价键(填“离子”或“共价”).
,其中的化学键属于共价键(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com