
| A. | HA是强酸 | |
| B. | 混合液中,c(HA)+c(A-)=0.4mol•L-1 | |
| C. | 混合液中,c(Na+)+c(H+)=$\frac{Ka(HA)•c(HA)+Kw}{c({H}^{+})}$ | |
| D. | 向混合液中加入蒸馏水,c(A-)与c(HA)的比值将增大 |
分析 A.二者恰好反应生成NaA,混合液的pH>7,说明NaA为强碱弱酸盐,HA为弱酸;
B.反应后溶质为0.2mol/L的NaA,根据混合液中的物料守恒判断;
C.$\frac{{K}_{a}(HA)•c(HA)}{c({H}^{+})}$=c(A-)、$\frac{{K}_{W}}{c({H}^{+})}$=c(OH-),结合电荷守恒判断;
D.混合液中溶质为NaA,加入蒸馏水后A-的水解程度增大,溶液中A-的物质的量减小、HA的物质的量增大.
解答 解:A.0.4mol•L-1 HA溶液与0.4mol•L-1 NaOH溶液等体积混合,二者物质的量相等,反应后溶质为NaA,反应后混合液的pH>7,说明NaA为强碱弱酸盐,HA为弱酸,故A错误;
B.反应后溶质为0.2mol/L的NaA,根据物料守恒可知:c(HA)+c(A-)=0.2mol•L-1,故B错误;
C.根据电离平衡常数概念可知:$\frac{{K}_{a}(HA)•c(HA)}{c({H}^{+})}$=c(A-),根据水的离子积可知:$\frac{{K}_{W}}{c({H}^{+})}$=c(OH-),溶液中满足电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-)=$\frac{{K}_{a}(HA)•c(HA)}{c({H}^{+})}$+$\frac{{K}_{W}}{c({H}^{+})}$=$\frac{Ka(HA)•c(HA)+Kw}{c({H}^{+})}$,故C正确;
D.向混合液中加入蒸馏水,A-的水解程度增大,溶液中A-的物质的量减小、HA的物质的量增大,由于在同一溶液中,根据c=$\frac{n}{V}$可知c(A-)与c(HA)的比值将减小,故D错误;
故选C.
点评 本题考查溶液酸碱性与溶液pH的关系、离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及电离平衡常数的表达式为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
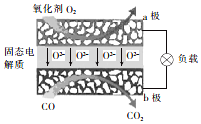 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )| A. | 电子从b极经导线流向a极 | |
| B. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 还可以选用NaOH固体作固态电解质 | |
| D. | 若反应中转移1 mol电子,则生成22.4L(标准状况)CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性比钾强 | B. | 最高价氧化物的化学式是SeO3 | ||
| C. | 高价含氧酸的酸性:H2SeO4>H2SO4 | D. | 氢化物稳定性:H2Se>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
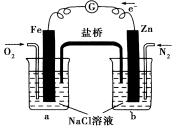
| A. | 烧杯b中发生还原反应 | |
| B. | 烧杯b中发生的反应为2Cl--2e-═Cl2↑ | |
| C. | 烧杯a中发生的反应为2H++2e-═H2↑ | |
| D. | 烧杯a中的溶液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
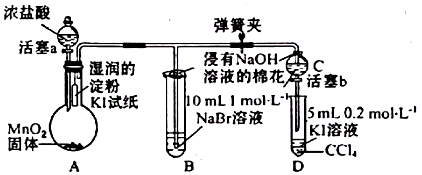
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
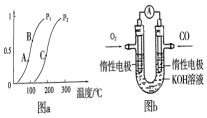 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com