
| A. | 称取1.06g无水Na2CO3,加入100mL容量瓶中溶解,定容 | |
| B. | 需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管 | |
| C. | 定容时俯视容量瓶刻度线,浓度偏高 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.1 mol•L-1 |
分析 A、配制溶液时,固体的溶解要在烧杯中进行,不能用容量瓶溶解,固体的称量用天平,精确度为0.1g;
B、需要使用的主要玻璃仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管;
C、判断不当操作对溶质的物质的量和溶液的体积的影响,根据c=$\frac{n}{V}$分析;
D、离子的浓度=溶质的浓度×1个溶质中含有的离子数目.
解答 解:A.配制100ml0.1mol/LNa2CO3溶液,应称取Na2CO3的质量为:0.1mol/L×0.1L×106g/mol=1.06g,即1.1g,在烧杯中溶于水,不能用容量瓶溶解,故A错误;
B.需要使用的主要玻璃仪器有烧杯、玻璃棒、100mL容量瓶,胶头滴管,故B错误;
C.定容时俯视容量瓶刻度线,会造成液面低于刻度线,V变小,根据c=$\frac{n}{v}$可知,配制溶液浓度偏高,故C正确;
D.取所配溶液10 mL,溶液的浓度不变,所取溶液中Na+浓度为0.2mol•L-1,故D错误;
故选C.
点评 本题考查了配制一定物质的量浓度溶液误差分析,明确配制原理,准确判断不当操作对溶质的物质的量和溶液的体积的影响是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN中碳元素的化合价为+2 | |
| B. | NaCN易与水反应,发生大爆炸,造成多名消防队员牺牲 | |
| C. | 可用强氧化剂如H2O2等将NaCN氧化为无毒物质 | |
| D. | 为防止中毒,须加强对地表水、排海口等的氰化物排查 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al2O3 $\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{20}}{→}$Ag(NH3)2OH(aq)$→_{△}^{蔗糖}$Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ① | C. | ③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.6mol/L | C. | 0.9 mol/L | D. | 1.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
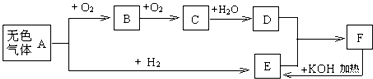
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com