
| A、若管道漏气遇氨气就会产生白烟 |
| B、该反应利用氨气有还原性 |
| C、该反应属于置换反应 |
| D、该反应氧化剂和还原剂的物质的量之比为3:8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 根据如图转化关系,回答:
根据如图转化关系,回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石蕊试液、AgNO3溶液、稀硝酸 |
| B、BaCl2溶液、酚酞试液、AgNO3溶液 |
| C、石蕊试液、BaCl2溶液 |
| D、酚酞试液、BaCl2溶液、AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
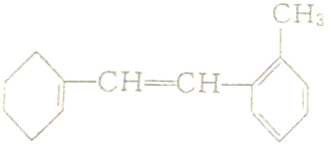
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、向Na[Al (OH)4]溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| C、25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)>V(NaOH) |
| D、AgCl易转化为AgI沉淀且KSP(AgX)=c(Ag+)?c(X-),故KSP(AgI)>KSP(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O5 |
| 450℃ |

| A、图Ⅰ表示的是温度对化学平衡的影响,且乙的温度较高 |
| B、图Ⅱ表示的是t1时刻充入气体氦后对反应速率的影响 |
| C、图Ⅲ表示的是升高温度对反应速率的影响 |
| D、图Ⅲ表示的是t1时刻增大O2的浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com