

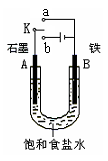
 H2↑+C12↑+2OH-(2分)
H2↑+C12↑+2OH-(2分) Al(OH)3 +3H+(1分) HS- + H2O
Al(OH)3 +3H+(1分) HS- + H2O H2S + OH-(1分)
H2S + OH-(1分) HA + OH-);
HA + OH-); Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)

科目:高中化学 来源:不详 题型:单选题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0–5 | 4.9×l0–10 | K1=4.3×l0–7 K2=5.6×l0–11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
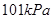 时,
时,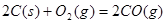 ;
;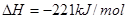
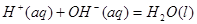 ;
;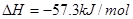
A.稀醋酸与稀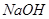 溶液反应生成 溶液反应生成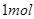 水,放出 水,放出 热量 热量 |
B.①的反应热为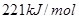 |
C.稀硫酸与稀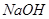 溶液反应的中和热为 溶液反应的中和热为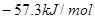 |
D.碳的燃烧热大于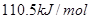 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+、AlO2-、Cl-、Na+ | B.K+、Fe2+、Cl-、NO3- |
| C.Na+、SO 42-、Cl-、NH4+、 | D.Na+、NO3-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.0 mol·L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42- |
| B.加入铝粉放出H2的溶液中:Al3+、K+、SO42—、Cl— |
| C.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN— |
| D.水电离产生的c(OH—)=10—12 mol·L—1的溶液中:K+、Mg2+、SO42—、NO3— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②显酸性,③④显碱性 | B.c(NH4+):④<③<② |
| C.溶液的pH:①<②<④ | D.②溶液中:c(NH4+)+c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝与NaOH溶液反应:2Al +2OH- ="=" 2AlO2-+ H2↑ |
| B.钠与水的反应:Na + H2O ="=" Na+ + 2OH-+ H2↑ |
| C.铜与稀硝酸反应:3Cu + 8H+ + 2NO3-="=" 3Cu2+ +2NO↑+ 4H2O |
| D.稀硫酸与氢氧化钡溶液反应:SO42-+ Ba2+==BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、Na+、SO42─、Cl─ | B.K+、Na+、MnO4─、NO3─ |
| C.OH─、HCO3─、Ca2+、Na+ | D.Ba2+、Na+、OH─、NO3─ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
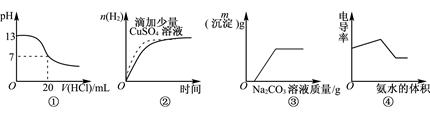
| A.图①表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向盐酸和醋酸混合溶液中滴入氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com