
| A. | NaOH溶液的导电能力一定比氨水强 | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH | |
| C. | 若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 | |
| D. | 将NaOH溶液和氨水各稀释一倍,两者的c(OH-)均减小到原来的一半 |
分析 A.导电能力大小与离子浓度有关;
B.盐酸和醋酸的物质的量相等,完全中和消耗等物质的量的氢氧化钠;
C.醋酸与盐酸的电离程度不同;
D.氨水溶液稀释,促进电离.
解答 解:A.氢氧化钠和氨水的浓度未知,不能确定导电能力大小,故A错误;
B.盐酸和醋酸的物质的量相等,完全中和消耗等物质的量的氢氧化钠,故B正确;
C.醋酸与盐酸的电离程度不同,若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)大于醋酸c(H+)的两倍,故C错误;
D.氨水溶液稀释,促进电离,将氨水稀释一倍,c(OH-)大于原来的一半,故D错误.
故选B.
点评 本题考查弱电解质的电离,侧重于学生的分析能力的考查,为高考常见题型,注意把握弱电解质的电离特点以及影响因素,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 一个D216O分子所含的中子数为8 | |
| B. | NH4Cl是只含非金属元素的共价化合物 | |
| C. | HCl的电子式为 | |
| D. | H2S不如HF稳定性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应类型加聚反应
反应类型加聚反应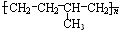 单体结构简式为CH2=CH2和CH3-CH=CH2.
单体结构简式为CH2=CH2和CH3-CH=CH2.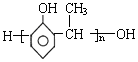 单体结构简式为
单体结构简式为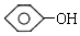 和CH3CHO.
和CH3CHO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
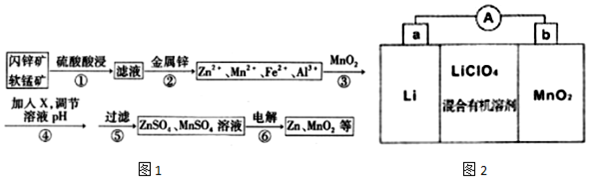
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1 Ca(ClO)2溶液中K+、Na+、I-、Cl-可以大量共存 | |
| B. | 氢氧化铁溶于氢碘酸中的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合液中c(CH3COOH)+c(CH3COO-)═c(NH4+)+c(NH3•H2O) | |
| D. | 常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,则:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
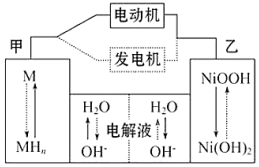
| A. | 充电时,阴极附近pH降低 | |
| B. | 电动机工作时溶液中OH-向甲移动 | |
| C. | 放电时正极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电极总反应式为:MH+NiOOH$?_{充电}^{放电}$M+Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
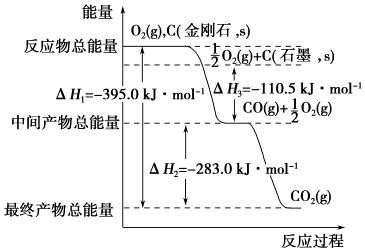
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目不相同 | |
| B. | 乙烷,苯,葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 与环己醇(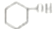 )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质在一定条件下均能水解 | |
| B. | 乙二醇、苯乙烯在一定条件下均可聚合生成高分子化合物 | |
| C. | 分子式为C4H8C12的有机物共有(不含立体异构)8种 | |
| D. | 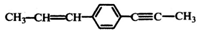 处于同一平面上的原子数最多为18个 处于同一平面上的原子数最多为18个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com