

分析 (1)分离不溶性固体和溶液采用过滤的方法,从碘水中获得碘采用萃取的方法;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多分离;
(3)从海藻提取碘的流程可知,浸泡后的悬浊液需要过滤除杂,对含碘离子的溶液加氧化剂氧化碘离子生成碘单质,然后萃取得到碘的有机溶液,以此来选择实验仪器;
(4)根据实验操作步骤①灼烧来分析选择用到的实验仪器;
(5)a、萃取的步骤:溶液和萃取液分别倒入分液漏斗,把分液漏斗倒转过来用力振荡,将分液漏斗放在铁架台上静置,待液体分层后,将漏斗上端玻璃塞打开,从下端放出下层液体,上端倒出上层液体;
b、旋开活塞,分离下层液体,使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;
c、从分液漏斗中流出液体是通过大气压强控制的;
解答 解:(1)将溶液和不溶性固体分离的方法是过滤,从碘水中获取碘单质采用萃取的方法,
故答案为:过滤 萃取;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,从题给信息可知;
A、苯、酒精中,酒精和水互溶,不能用作萃取剂,故A错误;
B、四氯化碳和苯与水互不相容,故可用四氯化碳或苯,故B正确;
C、汽油、乙酸中,乙酸和水互溶,不能用作萃取剂,故C错误;
D、汽油、酒精中,酒精和水互溶,不能用作萃取剂,故D错误;
故答案为:B;
(3)碘离子转化为碘的有机溶液,主要涉及灼烧、溶解过滤及分液、蒸馏等操作,过滤使用漏斗、烧杯、玻璃棒;分液需要分液漏斗等,缺少的仪器为分液漏斗,
故答案为:分液漏斗;
(4)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,
故答案为:ADE;
(5)a、萃取的步骤:检验分液漏斗活塞和上口的玻璃塞是否漏液,溶液和萃取液分别倒入分液漏斗,把分液漏斗倒转过来用力振荡,将分液漏斗放在铁架台上静置,待液体分层后,将漏斗上端玻璃塞打开,从下端放出下层液体,上端倒出上层液体,C→B→D→A→H→G→E→F,
故答案为:CBDG;
b、旋开活塞,分离下层液体,应使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出,
故答案为:使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;
c、从分液漏斗中流出液体是通过大气压强控制的,为了使液体顺利流出,将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,
故答案为:连通大气,使分液操作顺利进行;
点评 本题考查了海水资源的综合利用,涉及知识点较多,萃取操作、蒸馏时冷凝管中进出水口的判断等知识点都是常考查点,且也是易错点,题目难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| C. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| D. | Y的最高价氧化物对应的水化物能溶于稀氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 把NaOH固体放在托盘天平左盘的滤纸上称量 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
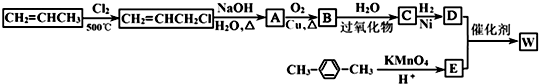
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸和硝酸银溶液 | B. | 氢气在氯气中燃烧 | ||
| C. | 钠与氧气的反应 | D. | 一氧化碳在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH═CH3COO-+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | HCO3-═H++CO32- | D. | HPO4-?H++PO43- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com