
| A. | 供电时的总反应是:2H2+O2=2H2O | |
| B. | 产物为无污染的水,属于环境友好电池 | |
| C. | 燃料电池的能量转化率无法达到100% | |
| D. | H2在负极发生还原反应 |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,对环境物污染,据此进行判断.
解答 解:A.电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2═2H2O,故A正确;
B.氢氧燃料电池产物是水,对环境物污染,且能量转化率高,故B正确;
C.氢氧燃料电池是将化学能转变为电能的装置,还会伴有热能等能量的释放,能量转化率不会达100%,故C正确;
D.由电极反应式可知,通入氢气的一极为电池的负极,发生氧化反应,故D错误;
故选D.
点评 本题考查了化学电源新型电池,题目难度中等,明确原电池工作原理为解答关键,注意掌握判断原电池两极的方法,要求学生能够正确书写电极反应式,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题

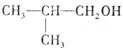 .
.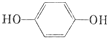 .
.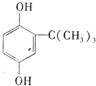 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
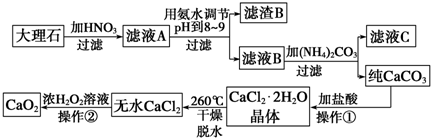
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
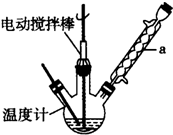 甲苯(
甲苯(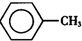 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(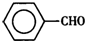 )、苯甲酸(
)、苯甲酸(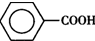 )等
)等| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
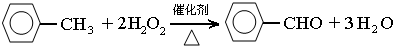 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为: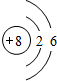 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
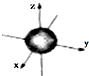
| A. | 3d3表示3d能级上有3个轨道 | |
| B. | ns能级的原子轨道图都可以用右图表示 | |
| C. | 1s电子云呈球形,表示电子绕原子核做圆周运动 | |
| D. | 电子云图的黑点密度越大,说明核外空间电子数越多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com