
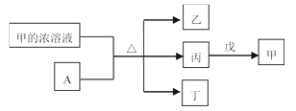
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,A遇甲的浓溶液发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体,上述物质的转化关系如下图所示,下列说法正确的是
A.由于丁和戊化学键相同,所以它们都是平面结构
B.简单氢化物的沸点: X>Z
C.简单离子半径大小: X<Y
D.Y的简单离子与Z的简单离子在水溶液中可大量共存
【答案】B
【解析】
短周期主族元素W、X、Y、Z的原子序数依次增加,A是元素Y的单质,常温下A遇甲的浓溶液钝化,可知A为Al单质,Y为Al元素,丙是无色气体,则甲为H2SO4、丙为SO2、丙、丁、戊是由这些元素组成的二元化合物,二氧化硫能被戊氧化为硫酸,可知丁为H2O,戊为H2O2,乙为Al2(SO4)3,则W、X、Y、Z分别为H、O、Al、S元素,据此分析结合元素性质解答。
A.丁为H2O,戊为H2O2,H2O中O原子杂化轨道数=σ键数+孤对电子对数=2+![]() =4,所以采取sp3杂化,分子构型为V型平面结构,H2O2的构型为二面角结构,像半开书页型一般,两个O在书轴上,两个氢分别和两个O相连,但不在同一平面上,结构如图所示:
=4,所以采取sp3杂化,分子构型为V型平面结构,H2O2的构型为二面角结构,像半开书页型一般,两个O在书轴上,两个氢分别和两个O相连,但不在同一平面上,结构如图所示: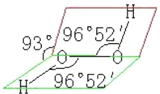 ,故A错误;
,故A错误;
B.X为O,Z为S,简单氢化物分别为H2O和H2S,水分之间存在氢键,使其熔沸点较高,H2S分子间没有氢键,熔沸点较低,则简单氢化物的沸点:X>Z,故B正确;
C.X、Y分别为O、Al元素,其简单离子的核外电子排布相同,核电荷数越大,半径越小,则简单离子半径大小:X>Y,故C错误;
D.Y、Z分别为Al、S元素,Y的简单离子为弱碱根(弱碱阳离子)离子,可水解生成氢氧化铝和氢离子,Z的简单离子为弱酸根离子,在水溶液水解生成硫氢根离子和氢氧根,二者放入同一溶液中可相互促进水解反应,则不能大量共存,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL, Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是

A.点c对应的溶液中有:c(B+)+c(BOH)=0.1molL-1
B.点b对应的溶液中有:c(B+)=c(A-)
C.曲线甲表示BOH溶液的体积与pH的关系曲线
D.在由点a到点c的过程,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是药物合成的一种中间体,可通过以下方法合成:

(1)B中官能团名称为_____________。
(2)G→H的反应类型为__________。
(3)已知C的一种同分异构体为: ,下列说法正确的是____________。
,下列说法正确的是____________。
a.能发生酯化反应
b.能发生银镜反应
c.1mol该物质完全水解能消耗3mol NaOH
d.该分子的核磁共振氢谱中峰面积之比为1∶2∶6∶2
e.其在酸性条件下的水解产物之一能与FeCl3溶液发生显色反应
(4) 中手性碳原子(一个碳原子上连有4个不一样的原子或者原子团)个数为________。
中手性碳原子(一个碳原子上连有4个不一样的原子或者原子团)个数为________。
(5)E的分子是为C14H17O3N,E经还原得到F,写出E→F的反应方程式:_______。
(6)已知:①
![]()

![]()

②苯胺( )易被氧化。请以甲苯和(CH3CO)2O为原料制备
)易被氧化。请以甲苯和(CH3CO)2O为原料制备![]() ,写出制备的合成路线流程图(无机试剂任选)。_________。
,写出制备的合成路线流程图(无机试剂任选)。_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①石墨 ②烧碱 ③石灰水 ④氯化钠晶体 ⑤盐酸 ⑥氨气 ⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液上述物质中能导电的是______,属于电解质的是_______,属于非电解质的是________。(填编号)
(2)按要求写出下列方程式:
①小苏打治疗胃酸过多的离子方程式:____________________。
②向氢氧化钠溶液中加入的铝片离子方程式:__________________。
(3)按要求进行化学计算:
①0.5mol某固体A的质量是40 g,A的相对分子质量为__________________。
②在同温同压同体积的条件下,H2与气体A的质量之比是1∶8,则A的摩尔质量为_____________。
③2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O,该反应氧化剂与还原剂的物质的量之比为________。
④98%的浓H2SO4(ρ=1.84 g/cm3)物质的量浓度为__________。
⑤相同物质的量浓度的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,当生成的AgCl质量相同时,消耗的三种溶液的体积比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知侯氏制碱法的主要反应为NaCl + NH3 + CO2 + H2O = NaHCO3↓ + NH4Cl。某实验小组模拟工业生产制备少量NaHCO3,将实验流程分为制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和操作能达到实验目的的是
A. 制取氨气B.
制取氨气B. 制取NaHCO3
制取NaHCO3
C. 分离NaHCO3D.
分离NaHCO3D. 干燥NaHCO3
干燥NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。下列说法不正确的是

A.该分解过程是:2NO![]() N2+O2
N2+O2
B.实验室制取NO可以用铜与稀硝酸反应
C.过程②释放能量,过程③吸收能量
D.标准状况下,NO分解生成5.6 LN2转移电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量NOx和SO2,可经处理消除。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+ 4NO2(g) 4NO(g)+CO2(g)+ 2H2O(g); H1=574.0 kJ ·mol-1
CH4(g)+4NO(g) 2N2(g)+ CO2(g)+ 2H2O(g); H2= 1160.0 kJ·mol-1
①反应CH4(g)+2NO2(g) N2(g)+CO2(g)+ 2H2O(g); H3=_____;
②若该反应中将NOx还原为N2,消耗标准状况下5.6L CH4,则反应过程中转移的电子物质的量为___;
(2)用CH4原NO2的反应为CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),向两个容积均为2L温度分别为T1°C、T2°C的恒温恒容密闭容器中分别加入物质的量为1 mol的CH4和2molNO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1_______T2(填“>”或“<”);
②T1°C时,40~80 min,用N2的浓度变化表示的平均反应速率为v(N2)=_____,此温度下的化学平衡常数K=______;
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_____移动(填“正向”、 “逆向”或“不”);
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)碱性混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2反应的离子方程式:__________________________;
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是____________________________ ( 答出一点即可);

(4)用碱液脱硝是目前研究的课题之一。
①将NO、NO2 控制物质的量之比接近1:1通入足量氢氧化钠溶液可制NaNO2溶液。请写出该反应的离子方程式______________________________。
②将工业上氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到下图所示的电解槽中进行电解。写出A室NO2发生的电极反应:____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如图,其总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是

A. 电极A是负极,发生氧化反应
B. 电池工作时,电解液中的H+通过质子交换膜向B电极迁移
C. 放电前后电解质溶液的pH不变
D. b物质在电极上发生的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,氦气在Pt催化剂作用下发生主反应Ⅰ和副反应Ⅱ:
Ⅰ.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-905 kJ/mol
4NO(g)+6H2O(g) △H1=-905 kJ/mol
Ⅱ.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2
2N2(g)+6H2O(g) △H2
(1)已知:
物质中断裂1mol化学键需要的能量/kJ | NO | O2 | N2 |
629 | 496 | 942 |
则△H2=___________。
(2)以Pt为催化剂,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量与温度的关系如下图:
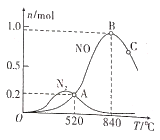
①该催化剂在高温时对反应__________更有利(填“Ⅰ”或“Ⅱ”)。
②520℃时,NH3的转化率为____________。
③520℃时,反应Ⅱ的平衡常数K=________(数字计算式)。
④下列说法正确的是____________(填标号)。
A 工业上氨催化氧化生成NO时,最佳温度应控制在840℃左右
B 增大NH3和O2的初始投料比可以提高NH3生成NO的平衡转化率
C 投料比不变,增加反应物的浓度可以提高NH3生成NO的平衡转化率
D 使用催化剂时,可降低反应的活化能,加快其反应速率
⑤温度高于840℃时,NO的物质的量减少的原因可能是____________。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子数为___________mol。
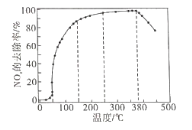
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如下图所示,在50-250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com