
【题目】下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
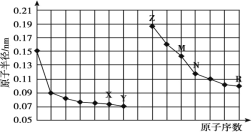
A.最高价氧化物对应水化物的碱性:Z<M
B.X、N 两种元素形成的化合物属于离子化合物
C.Y、R 两种元素气态氢化物的稳定性:Y>R
D.简单离子的半径:Z>M>X
【答案】C
【解析】
同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可以知道X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素。
A.同周期元素从左到右元素的金属性逐渐减弱,金属性越强,对应的最高价氧化物对应水化物的碱性越强,所以碱性强弱为:Z>M,A错误;
B.X、N两种元素组成的化合物为二氧化硅,二氧化硅是由原子组成,属于共价化合物,B错误;
C.气态氢化物的稳定性和非金属性有关,非金属性越强,气态氢化物越稳定,非金属性Y>R,Y、R 两种元素气态氢化物的稳定性:Y>R,C正确;
D.离子电子层结构相同,核电荷数越大,离子半径越小,所以简单离子的半径:M<Z<X,D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )
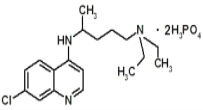
A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.若升高温度,W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是 K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工程师为了从腐蚀废液(含有Cu2+、Fe2+、Fe3+)中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

(1)请写出上述实验中加入或生成的有关物质的化学式。
①=__________,② __________,③__________,④__________,⑤__________,⑥__________。
(2)请写出相关反应的化学方程式:______,_____________,__________,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种常用燃料(1mol)完全燃烧时放出的热量:
物质 | 炭粉(C) | 一氧化碳(CO) | 氢气(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是___。
(2)写出管道煤气中的一氧化碳燃烧的热化学方程式___。
(3)充分燃烧1mol表中各种燃料,排放出二氧化碳的量最多的是___。
(4)矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有氢能、___等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁与氯气的反应,某同学甲设计了如下的实验方案(已知FeCl3加热时易升华)。其实验装置图为(加热用的酒精灯已略去):
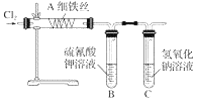
(1)试管B中的现象是___________,反应的离子方程式为____________。
(2)试管C中氢氧化钠溶液的作用是____________,反应的离子方程式为_________。
(3)某同学乙猜测铁与氯气反应可能还会生成氯化亚铁,为了探究生成物中是否含有氯化亚铁(假设铁已完全反应),请你设计实验方案:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:
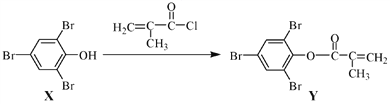
下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上 B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色 D. X→Y的反应为加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn、Fe及其化合物在生产生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:

(1)为了提高酸浸效率,可采用的措施有___________________________________(任答两条);
写出ZnFe2O4溶于酸的离子方程式____________________________________
(2)向净化Ⅰ操作中加入ZnO的目的___________________________________
(3)若净化后的溶液中Cu2+浓度为1×10-12mol/L,则净化后溶液中Zn2+浓度为__________(已知:室温下Ksp(ZnS)=1.6×10-24, Ksp(CuS)=6.4×10-36)
(4)“电解”工艺制锌时Zn2+利用率较低,废液中有大 量的Zn2+ 残留。某化工厂拟采用改变酸锌比净化废液的方式来提高原料的利用率,降低成本。如图是工业生产中不同酸锌比时净化液利用率对电解时直流电耗能影响关系图。根据图分析,该工厂净化废液时的最佳酸锌比为______。

A. 5:1 B.6:1 C.7:1 D.10:1
(5)ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为_______________________________________。测热分解后产品中ZnFe2O4的质量分数方法如下:取a克产品用H2SO4溶解后加入足量KI溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用c mol/L Na2S2O3标准溶液滴定,用去此标准溶液v mL时,刚好到达滴定终点,则此产品中ZnFe2O4的质量分数为____________(用a、c、v表示)。(已知:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com