
 H2��I2
H2��I2
 2HI(g)��ƽ�ⳣ��K��__________________
2HI(g)��ƽ�ⳣ��K��__________________ =64mol/L��
=64mol/L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
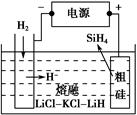
 Si(s)��3HCl(g)��
Si(s)��3HCl(g)��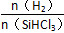 ʱ����Ӧ��X��ƽ��ת���ʹ�ϵ��ͼ��ʾ��
ʱ����Ӧ��X��ƽ��ת���ʹ�ϵ��ͼ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 CO(g) + 3H2(g) ��H =" +206.2" kJ/mol
CO(g) + 3H2(g) ��H =" +206.2" kJ/mol CO2(g) +4H2(g) ��H = +165.0kJ/mol
CO2(g) +4H2(g) ��H = +165.0kJ/mol

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������



| A�������¶� | B�������������� | C����Сѹǿ | D��ʹ���˸�Ч���� |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CaCO3(s)=CaO(s)��CO2(g)�����²����Է����У�˵���÷�Ӧ�ġ�H��0 |
| B����ͭ����Ʒ�Ʋ����������Ʒ������ǰ���������� |
C��N2(g)��3H2(g) 2NH3(g) ��H��0��������������ʱ�����¶ȣ���Ӧ���ʣ�(H2)��������ƽ��ת���ʾ����� 2NH3(g) ��H��0��������������ʱ�����¶ȣ���Ӧ���ʣ�(H2)��������ƽ��ת���ʾ����� |
| D��ˮ�����ӻ�����Kw�����¶ȵ����߶�����˵��ˮ�ĵ����Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����Ƿ��ȷ�Ӧ�����Է��ġ� |
| B�����ܵ���ʵ��ܽ�ƽ����һ�ֶ�̬ƽ�� |
| C�����ó�����Ӧ����ʱ����ʹ����������ȫ���� |
| D��pH��5������ϡ��1000������Һ��pH����8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 1/2N2O4��g�� ��H =��26��35 kJ��mol��1
1/2N2O4��g�� ��H =��26��35 kJ��mol��1 2NH3��g�� ��H��0��Ӱ����ͼ��ʾ��
2NH3��g�� ��H��0��Ӱ����ͼ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H2(g) + CO2(g)��ƽ�ⳣ�����¶ȵı仯���±���
H2(g) + CO2(g)��ƽ�ⳣ�����¶ȵı仯���±���| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
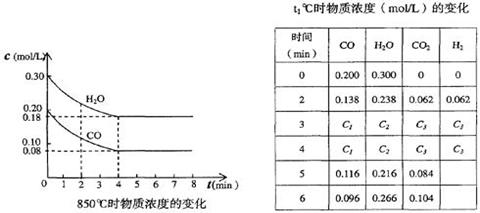
| ʱ �䣨min�� | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
 1/2N2O4(g) ��H = ��26.35 kJ��mol��1
1/2N2O4(g) ��H = ��26.35 kJ��mol��1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 H2(g)��CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���
H2(g)��CO2(g)���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���| �¶�/�� | 400 | 500 | 830 |
| ƽ�ⳣ��K | 10 | 9 | 1 |
| ʵ���� | ��Ӧ��Ͷ���� | ƽ��ʱH2Ũ�� | ���ջ�ų������� | ��Ӧ��ת���� |
| A | 1��1��0��0 | c1 | Q1 | ��1[��Դ:] |
| B | 0��0��2��2 | c2 | Q2 | ��2 |
| C | 2��2��0��0 | c3 | Q3 | ��3 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com