
已知:2Na[Al(OH)4]+CO2—→2Al(OH)3↓+Na2CO3+H2O。向含2 mol NaOH、1 mol Ba(OH)2、2 mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 3 |
答案 AC
解析 向含2 mol NaOH、1 mol Ba(OH)2、2 mol Na[Al(OH)4]的混合溶液中慢慢通入CO2发生反应依次为
2NaOH +CO2 —→ Na2CO3 +H2O
2 mol 1 mol 1 mol
Ba(OH)2 + CO2 —→ BaCO3↓+H2O
1 mol 1 mol 1 mol
2Na[Al(OH)4]+CO2—→2Al(OH)3↓+Na2CO3+H2O
2 mol 1 mol 2 mol 1 mol
Na2CO3+CO2+ H2O—→2NaHCO3
1 mol 1 mol
BaCO3+CO2+H2O—→Ba(HCO3)2
1 mol 1 mol
当通入2 mol CO2时,生成1 mol BaCO3沉淀;
当通入3 mol CO2时,生成1 mol BaCO3沉淀和2 mol Al(OH)3沉淀;
当通入4 mol CO2时,生成1 mol BaCO3沉淀和2 mol Al(OH)3沉淀;
当通入5 mol CO2时,生成2 mol Al(OH)3沉淀;当通入 6 mol CO2时,BaCO3已完全反应,Al(OH)3量不变,即仍为 2 mol 沉淀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )

A.W、R元素单质分子内的化学键都是非极性键
B.X、Z元素都能够形成双原子分子
C.键能W-H>Y-H,键的极性Y-H>W-H
D.键长X-H<W-H,键能X-H<W-H
查看答案和解析>>
科目:高中化学 来源: 题型:
依据Mg、Al单质的性质,思考回答下列问题。
(1)铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能?
(2)Al既能溶于强酸,又能溶于强碱,所以说“Al既有金属性,又有非金属性”你认为这种说法是否恰当?为什么?
(3)铝与酸、碱反应的实质是什么?氧化剂是什么?
(4)镁在空气中充分燃烧,所得固体产物可能有哪些:________________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线,下列判断错误的是( )
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlO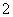 的物质的量的变化
的物质的量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
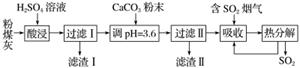
(1)酸浸时反应的化学方程式为________________________________;滤渣Ⅰ的主要成分为________________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________________________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是________________________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是________________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质时,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
将镁、铝的混合物共0.2 mol, 溶于200 mL 4 mol·L-1的盐酸溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
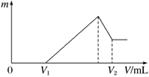
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160 mL时,则金属粉末中n(Al)=________ mol。
(2)0~V1段发生的反应的离子方程式为__________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4 mol·L-1的硫酸溶解此混合物后,再加入840 mL 2 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国已经成功研制出了碱金属的球碳盐K3C60。实验测知该物质在熔融状态下可以导电,而且在超临界温度18 K时具有超导性。
(1)K3C60含有化学键的类型为__________________(填“极性键”、“非极性键”或“离子键”)。
(2)1 mol K3C60含有的离子数目为________。
(3)K3C60中的C60俗称足球烯,分子结构酷似足球,由12个正五边形与20个正六边形构成,碳碳键长介于碳碳单键与碳碳双键之间,则其中碳的杂化方式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,相同物质的量浓度的下列溶液:①NaCl
②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④
C.④>①>②>③ D.③>②>①>④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com