
| A. | ①②③⑦ | B. | ①⑤⑥ | C. | ②③④⑦ | D. | ③⑤⑥ |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.可用sp2杂化轨道来解释说明中心原子含有3个价层电子对,据此分析判断.
解答 解:①BF3分子中价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,中心原子杂化类型分别为sp2,故①正确;
②CH2═CH2 分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,每个碳原子杂化轨道数为3,所以采取sp2杂化,故②正确;
③苯分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,杂化轨道数为3,所以采取sp2杂化,故③正确;
④CH≡CH分子中每个碳原子形成1个C-H,1个C≡C三键,碳原子价层电子对个数=2+$\frac{1}{2}$(4-4×1)=2,每个碳原子杂化轨道数为2,所以采取sp杂化,故④错误;
⑤NH3中N原子杂化轨道数为$\frac{1}{2}$(5+3)=4,采取sp3杂化方式,故⑤错误;
⑥CH4中碳原子价层电子对个数=4+0=4,为sp3杂化,故⑥错误;
⑦HCHO分子中碳原子价层电子对个数=3+$\frac{1}{2}$(4-4×1)=3,每个碳原子杂化轨道数为3,所以采取sp2杂化,故⑦正确;
故选A.
点评 本题考查了原子杂化类型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数=$\frac{1}{2}$(a-xb)中各个字母的含义,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: | B. | S2-的结构示意图: | ||
| C. | HF的电子式: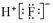 | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
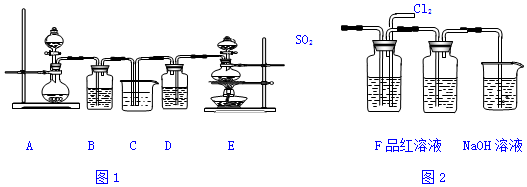
 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>M>N>X>Y | B. | M与N形成的化合物中N显正价 | ||
| C. | 单质沸点:Z>M>N>Y>X | D. | 最高正价:N>M=Y>Z=X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | RCl | B. | RCl2 | C. | RCl3 | D. | RCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气为纯净物 | |
| B. | 天然气是不可再生的能源 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 过量的CH4和Cl2在光照条件下反应只生成CH3Cl和HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com