
pH=5和pH=3的两种盐酸以1∶2体积比混合,该混合液的pH为( )
A.3.2 B.4.0 C.4.2 D.5.0
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是( )
A.过氧化钠的电子式:
B.质子数为35、中子数为45的溴原子: Br
Br
C.硫离子的结构示意图: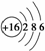
D.间二甲苯的结构简式: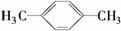
查看答案和解析>>
科目:高中化学 来源: 题型:
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为 。
(2)装置B所盛的试剂是 ,其作用是 。
(3)装置C所盛试剂是 ,C 中反应的离子方程式是 。
(4)由此得到结论,酸性 : > >
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室用锌片和稀硫酸反应制取氢气,并验证氢气的还原性及回收硫酸锌晶体。
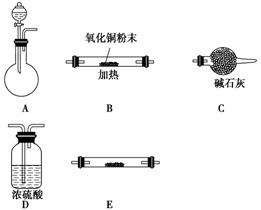
①各仪器的连接顺序为__________,装置E中盛放的试剂为__________,装置C的作用是________________________。
②锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从BaCl2溶液、Zn粉、NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程______________________________。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
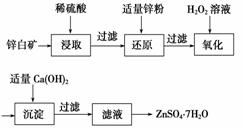
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7、6.5、9.7。
①为了提高酸浸效率,可以采取的措施有__________________(写出两条即可)。
②加入适量锌粉的作用为________________。
③氧化过程中H2O2发生反应的离子方程式为______________________________。
④由滤液得到ZnSO4·7H2O的操作依次为__________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
在 某温度时,测得纯水中[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
某温度时,测得纯水中[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
A.2.0×10-7 mol·L-1
B.0.1×10-7 mol·L-1
C.1.0×10-14/2.0×10-7 mol·L-1
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列四种溶液:
①1 mol·L-1的盐酸
②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液
④0.001 mol·L-1的NaOH溶液。
四种溶液中,由水电离生成的[H+]之比为____ ____。
____。
查看答案和解析>>
科目:高中化学 来源: 题型:
由粗硅制纯硅过程如下:
Si(粗)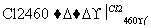 SiCl4
SiCl4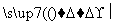 SiCl4(纯)
SiCl4(纯)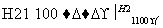 Si(硅)
Si(硅)
写出SiCl4的电子式:________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Ba2+、NO3-、SO42-、Cl-、CO32-,实验如下:
| 实验步骤 | 实验现象 |
| ①取少量原溶液,加入几滴酚酞试液 | 溶液变成红色 |
| ②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4 | 有无色气体产生,该气体遇空气变成红棕色 |
| ③取少量原溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液 | 有白色沉淀生成 |
由此判断:
(1)溶液中肯定存在的离子是________________________,肯定不存在的离子是________________,可能存在的离子是________________。
(2)实验②中生成无色气体的离子方程式是
________________________________。[学优高考网gkstk]
(3)为进一步确定可能存在的阴离子,应该补充的实验设计是
__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com